au sommaire
Dix bébés étaient traités pour une maladie génétique appelée DICS-X. Ce déficit génétique entraîne l'absence totale de cellules immunitaires, laissant la porteporte ouverte à toutes les infections. Pour les protéger ces enfants sont donc obligés de vivre dans des bulles stériles, d'où le nom de " bébés bulles " qui leur est communément donné.
En dehors de la thérapie génique, seule une greffe de moelle osseuse peut permettre à ces enfants de guérir, seulement dans 80 % des cas il est impossible de trouver un donneur compatible. Le traitement de cette maladie a constitué la première réussite de thérapie génique, mais comme toute nouvelle technologie des effets secondaires étaient envisageables. Parmi les 10 enfants traités, 9 ont montré une amélioration importante de leur santé leur permettant de sortir de leur bulle. Cependant après quelques mois deux des enfants ont développé une leucémie. En attendant d'en déterminer l'origine tous les essais ont été arrêtés.
Activation du mauvais gène
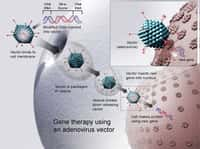
Le protocoleprotocole de thérapie génétique consistait à insérer un gènegène fonctionnel aléatoirement dans les chromosomeschromosomes des cellules précurseurs des lymphocyteslymphocytes TT ex-vivo puis de réinjecter ces cellules modifiées chez l'enfant. L'insertion du gène fonctionnel codant pour un récepteur de l'interleukineinterleukine 2 s'effectue grâce à un vecteur dérivé d'un rétrovirusrétrovirus.
Les scientifiques estiment à environ 1 x 10-5 la probabilité que l'insertion s'effectue dans un autre gène actif. Les bébés ayant reçu 1 x 106 cellules ou plus, ils ont donc statistiquement reçut entre 1 et 10 cellules dans lesquelles l'intégration du vecteur s'était faite dans une région active des chromosomes. Les travaux publiés indiquent que l'insertion du vecteur à proximité d'un proto-oncogèneproto-oncogène (gène pouvant provoquer un cancercancer) chez les deux jeunes enfants atteints de leucémie, a induit l'activation d'un gène nommé LMO2 qui est normalement inactif. Ce gène code pour un facteur de transcriptiontranscription impliqué dans l'hématogenèse.
Ce genre d'activation à distance des gènes par les rétrovirus est bien connus, et l'on estime qu'avec environ 100 proto-oncogènes dans le génomegénome humain la probabilité de dérégulation d'un tel gène est comprise entre 0,1 % et 1 % des évènements d'insertion du vecteur rétroviral.
Le site d'insertion est théoriquement aléatoire, cependant le fait que chez deux enfants le même site d'insertion ait été détecté semble indiquer qu'il existerait des sites d'insertions privilégiés. Ainsi, l'hypothèse privilégiée est que la dérégulation du gène LMO2 ait donné un avantage à ces cellules dont la multiplication anarchique a provoqué la leucémie.
Cependant cette hypothèse n'explique pas tout et il est fortement probable que d'autres paramètres sont entrés en compte. En effet, l'insertion du vecteur près du gène LMO2 a été détectée chez un troisième enfant, sans pour autant que cela ne provoque de leucémie. Parmi les différents autres paramètres, deux sont favorisés L'age des enfants, en effet les deux enfants atteints de leucémie étaient les plus jeunes patients traités parmi les dix (ils avaient respectivement 1 et 3 mois). Or il est connu que plus les cellules sont jeunes, plus elles sont capables de se multiplier. Ensuite, ces deux patients sont ceux qui on reçut la plus grande quantité de cellules génétiquement modifiées. Des études supplémentaires seront nécessaires afin de déterminer toutes les raisons de ces complications.
Les solutions pour l'avenir
Etant donné les promesses de la thérapie génique pour de nombreuses maladies actuellement incurables, il est essentiel de développer de nouveaux vecteurs de thérapie génique pour limiter les effets néfastes. Trois axes de recherche sont développés :
1. Développement de vecteurs limitant les insertions génotoxiquesgénotoxiques (comme le cas d'activation de gènes normalement éteints)
2. Désigner des sites d'intégration sans risque dans le génome, et construire des vecteurs capables de s'y intégrer spécifiquement.
3. Réduire la quantité de cellules exposées au vecteur pour l'intégration, puis réinjectées chez le malade. Ainsi en diminuant la quantité de cellules souchescellules souches manipulées, et en caractérisant le site d'insertion du vecteur avant ré-injection, la sécurité des malades devrait être grandement améliorée.