au sommaire
- Un vaccin contre le Sida, est-ce possible ?

Depuis ce vendredi, les chaînes de télévision se mobilisent et affichent en permanence le numéro qu'il ne faudra pas oublier de composer : le 110. Au bout du fil, les bénévoles du Sidaction enregistrent les dons, et ce jusqu'au 11 avril. « Face au Sida, chaque euro en plus peut faire la différence ! » Pour sa trentième année d'existence, l'association entend bien atteindre des records de collecte, afin de faire avancer la recherche et aider les 30 millions de malades dans le monde, dont 150.000 vivent en France.
Car si aujourd'hui la trithérapie permet aux séropositifs de vivre presque normalement, il n'existe toujours pas de traitement préventif ni curatifcuratif (excepté le cas d'une personne qui serait guérie du Sida grâce à une greffe de moelle osseuse). Les laboratoires de recherche ne cessent d'avancer pas à pas, pour un jour parvenir, espérons-le, à l'ultime solution : l'obtention d'un vaccin.
Un vaccin : l’objectif universel d’une équipe cosmopolite
Des scientifiques de l'Université de Californie à Davis, du Commissariat à l'énergieénergie atomique en France, du Karolinska Institute en Suède et des laboratoires Novartis ont ainsi tout récemment identifié une nouvelle cible, qui serait vraisemblablement utilisable pour un vaccin potentiel, car elle est moins variable que les autres régions du virusvirus. Ces travaux ont été publiés dans la revue Proceedings of the National Academy of Sciences.
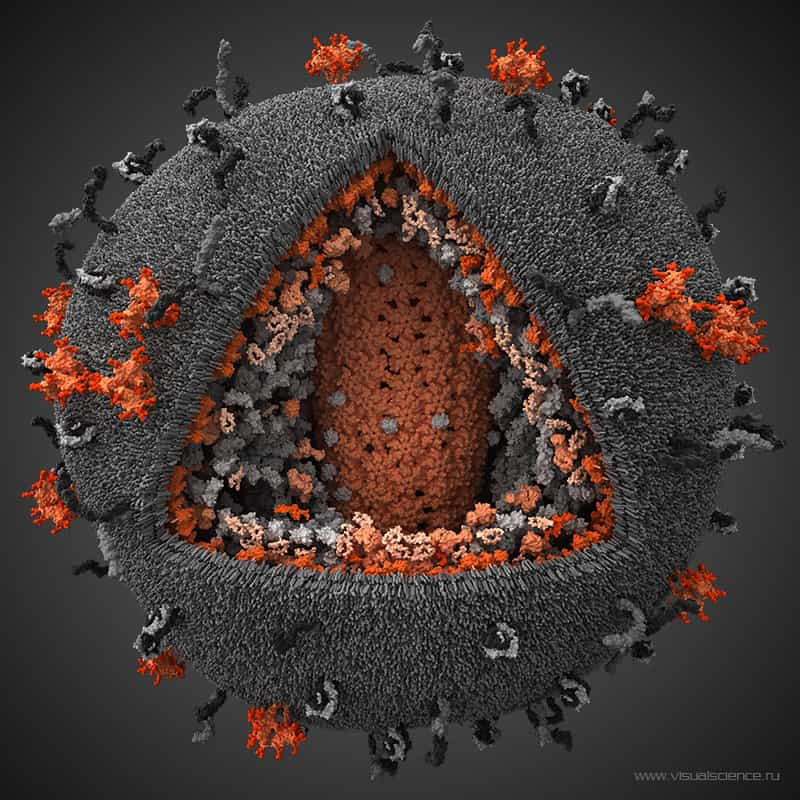
Les chercheurs voulaient au départ mieux connaître la structure tridimensionnelle des protéinesprotéines retrouvées en surface du virus, car elles constituent les premiers éléments viraux à être exposés à l'attaque du système immunitairesystème immunitaire et à pouvoir être ciblés par des anticorps. Les deux protéines d'enveloppe, la glycoprotéineglycoprotéine 120 (gp120) et glycoprotéine 41 (gp41), y échappent malheureusement grâce à leur forte capacité à acquérir des mutations.
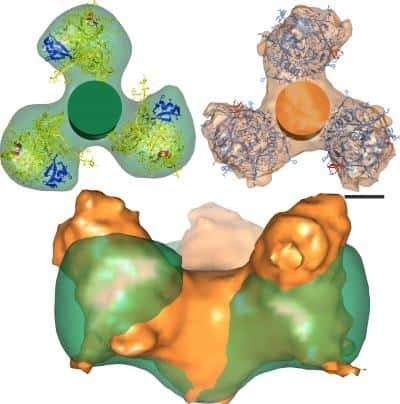
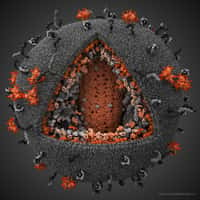
Les protéines d’enveloppe du VIH avant (en orange) et après (en vert) leur attachement au récepteur CD4 du lymphocyte, vue d’au-dessus (en haut) ou de côté (en bas). Elles subissent une rotation et un écrasement. © R. Holland Cheng
Observer les molécules grâce au froid
Le rôle de ces protéines est déjà très bien connu des virologistes du monde entier. Elles s'associent sous forme de trimères, les trois gp120 situées à l'extrémité des trois gp41, insérées quant à elles dans la membrane. Dans ce complexe, gp120 exécute la première étape d'infection, en s'attachant au récepteur CD4 situé en surface des lymphocyteslymphocytes TT (les cellules immunitaires ciblées par le virus). Puis gp41 prend le relais, en formant un trou dans la membrane cellulairemembrane cellulaire pour créer une porteporte d'entrée au virus.
Pour mieux comprendre les modifications conformationnelles du virus liées à l'attachement au récepteur cellulaire, les chercheurs ont utilisé la cryomicroscopie électroniquecryomicroscopie électronique. Contrairement à d'autres techniques (notamment la cristallographiecristallographie) qui utilisent des traitements dénaturants pour fixer l'échantillon, la cryomicroscopie consiste à congeler très rapidement l'échantillon (cryo signifie « froid »)) dans l'azoteazote liquideliquide (à -195°C) et permet donc d'observer les formes tridimensionnelles des moléculesmolécules dans leur forme native, puis de les reconstituer par modélisationmodélisation.
gp120, cible d’un vaccin ?
C'est donc en comparant les structures des protéines d'enveloppe associées et non associées au récepteur CD4 que les chercheurs ont découvert une rotation et un écrasement du complexe gp120-gp41. Ce changement structural entraîne l'exposition d'une partie cachée de la protéine gp120, qui pourrait alors subir les assauts d'anticorpsanticorps.
L'avantage ? Cette partie de la protéine est beaucoup moins variable que le reste de la molécule, un élément essentiel dans le développement d'un futur vaccin contre le virus du Sida ! Les chercheurs prévoient maintenant de tester des anticorps prélevés sur des patients ayant été exposés au virus mais sans avoir été infectés, pour déterminer s'ils ciblent bien la région du virus en question.