au sommaire

Le premier bébé-médicament français doit permettre de soigner sa sœur aînée atteint de bêta-thalassémie. © Etolane, Flickr, CC
Alors que les lois françaises de bioéthique sont en pleine mutation pour s'adapter au mieux aux techniques médicales toujours plus poussées, le premier bébé-médicament issu des pratiques de médecins français est né le 26 janvier dernier à l'hôpital Antoine Béclère à Clamart. Pesant 3,650 kilogrammeskilogrammes et apparemment en très bonne santé, le petit garçon nommé Umut-Talha (umut signifie espoir en turc, la langue des parents) est né pour la bonne cause. Sa mission : sauver l'un de ses aînés, atteint d'une grave maladie génétique.
Heureusement pour lui, Umut-Talha ne subira aucune opération chirurgicale ni aucun acte médical qui pourrait lui nuire. En réalité, seules les cellules contenues dans le sang de son cordon ombilical, en fait issu du sang placentaire, seront nécessaires pour soigner sa grande sœur, souffrant de β-thalassémie. Cette maladie, qui déforme les chaînes protéiques de l'hémoglobine des globules rouges et qui perturbe donc l'oxygénation de l'organisme, est due à une mutation génétique. Alors que toutes les cellules possèdent la mutation, seules les hématies en subissent la conséquence et doivent donc être remplacées selon deux scénarios possibles.
Soigner la β-thalassémie
Pour la grande sœur d'Umut-Talha, le remplacement des cellules malades se fait aujourd'hui grâce à des transfusionstransfusions régulières d'un donneur sain. L'autre solution, apportée par le bébé-médicament, est une injection par intraveineuse de sang ombilical sain et compatible.
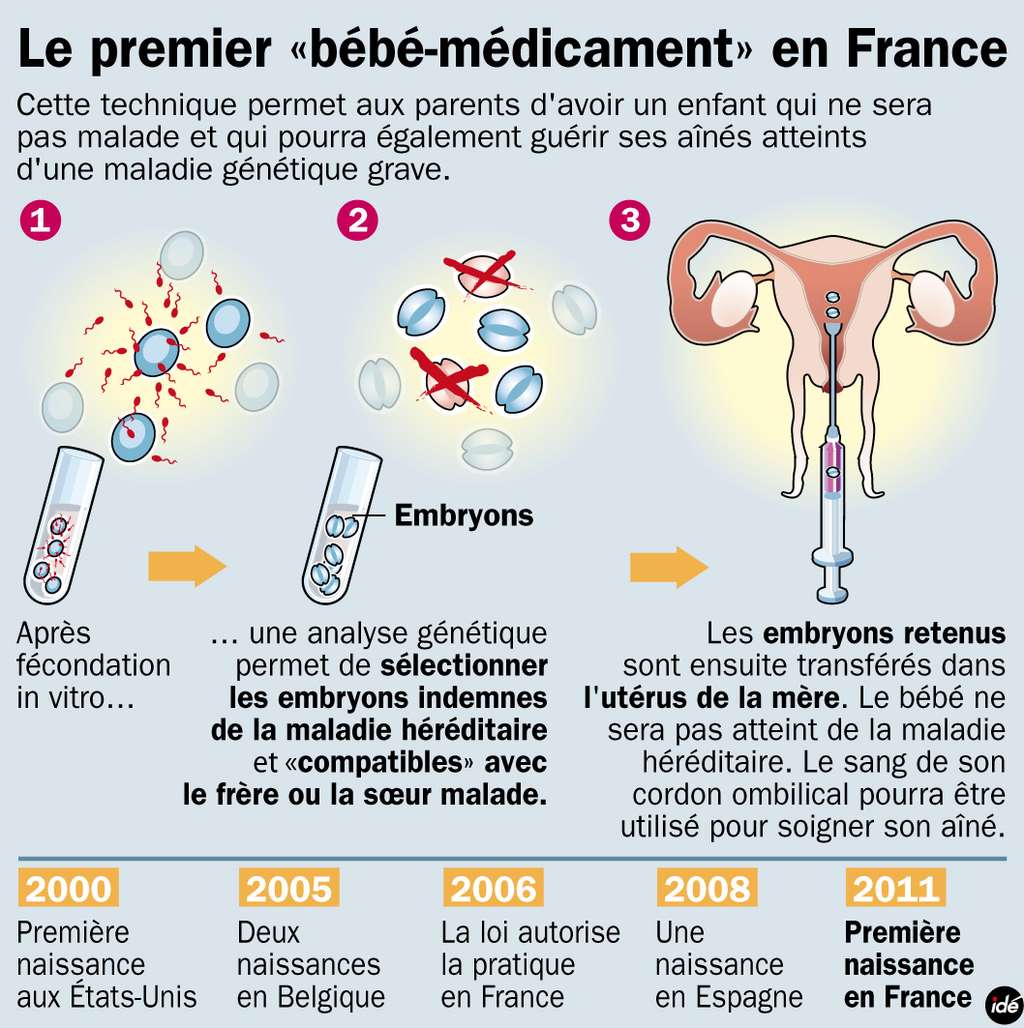
Il aura fallu onze ans pour que la technique permettant la naissance de bébés-médicaments soit appliquée pour la première fois en France. © ide.fr
Le sang de cordon possède la particularité de contenir de nombreuses cellules souchescellules souches, pluripotentes et donc hématopoïétiques, qui migreront spontanément vers la moelle osseusemoelle osseuse pour remplacer celle de l'enfant malade. Les cellules sanguines et immunitaires issues des cellules hématopoïétiques de cette nouvelle moelle osseuse seront alors dépourvues de la mutation génétique délétère, et l'enfant de sa maladie.
Greffe de sang de cordon, une pratique qui se démocratise
Selon l'agence de la biomédecine, le recours aux greffesgreffes de sang de cordon est en constante augmentation en France, jusqu'à atteindre 22,5 % de l'ensemble des greffes de cellules souches hématopoïétiques en 2008. Il concerne les personnes nécessitant des greffes de moelle osseuse (leucémique...)), qui n'ont pas trouvé de donneur compatible au sein de leur famille ni parmi le registre des donneurs volontaires. Un deuxième registre existe alors, listant les sangs de cordon disponibles, dont les mères en ont fait le don à la naissance, et qui sont congelés et conservés dans une banque publique de sang de cordon.
Le greffe de sang de cordon présente l'avantage de nécessiter une compatibilitécompatibilité moins parfaite entre le donneur et le receveur qu'une greffe de moelle osseuse. Mais dans le cas de bébés-médicaments, deux points sont à vérifier selon un processus appelé double diagnostic génétique préimplantatoire (DPIDPI), pour choisir les embryonsembryons obtenus par fécondation in vitro présentant un génomegénome adapté. Le premier point est l'absence de la mutation génétique portée par sa sœur malade, et le deuxième point concerne la compatibilité de leur système HLAHLA (Human Leukocyte Antigen).

Une à deux cellules de l'embryon sont analysées au troisième jour après la fécondation in vitro. © K. Hardy, Welcome Images, CC by-nc-nd 2.0
Une double vérification génétique
Pour réaliser ces deux vérifications, un ou deux blastomèresblastomères (cellule embryonnaire) sur un total de six ou huit, sont prélevés par biopsiebiopsie sur les embryons au troisième jour après la fécondationfécondation. Grâce à des outils de biologie moléculairebiologie moléculaire (par amplification d'ADNADN ou hybridationhybridation fluorescente in situ), leur contenu génétique est analysé et l'absence des affections suspectées est vérifiée. Les embryons présentant les caractéristiques recherchées sont finalement réimplantés dans l'utérusutérus et ne gardent à priori aucune séquelleséquelle de ce prélèvement. D'un point de vue psychologique, l'enfant né d'un tel processus portera-t-il le poids de sa fonction ? La question reste ouverte.
Encore une fois, le gynécologuegynécologue-obstétricien René Frydman, déjà habitué aux « premières » françaises (naissance du premier bébé-éprouvette, Amandine en 1982 et de jumeaux nés d'ovocytes congelés, Keren et Jérémie en 2010), est à l'origine de cette naissance médiatisée. Mais plus d'une dizaine de personnes de l'hôpital Necker et de l'hôpital Antoine Béclère voient leur nom associé au travail.