au sommaire

La capacité des moules à se fixer sur des supports très divers restait une énigme pour les chimistes. Le secret de leur supercolle est enfin dévoilé. © Benoît Deniaud, Flickr, CC by-nc-sa 2.0
Toutes petites, elles sont libres, planctoniques. Mais rapidement, les moules vont se fixer à un support (rocher, corde, coque de bateau) et y passer leur vie. Le milieu est hostile : eau, sel, forts courants, impact des vagues, soleilsoleil à maréemarée basse... Mais ces mollusques n'ont pourtant aucun mal à rester accrochés grâce à une glandeglande sécrétant le byssus, une forme de colle très puissante qui durcit sous forme de filaments.
L'adhérence remarquable de la moule de Californie (Mytilus californianus) n'a pas laissé de marbre l'équipe de Jing Yu et Herbert Waite, qui ont voulu en savoir davantage. Pour cela, ils sont allé inspecter, au niveau moléculaire, ce qui se produit lorsque les filaments du byssus se forment.
Une colle très efficace mais fragile
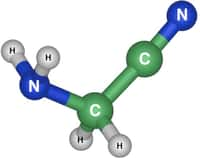
L'extension de la glande du byssus crée une zone où les conditions sont contrôlées par le mollusque. Là, elle sécrète différents types de protéinesprotéines appelées « protéines du pied » (ou mfp, pour l'anglais mussel foot proteines) qui vont former la plaque d'accroche au support. Les protéines de type mfp-3 et mfp-5 sont riches en un acide aminéacide aminé particulier appelé « Dopa ». Comme l'indique son nom complet, 3,4-dihydroxyphénylalanine, il possède deux groupements hydroxyles (OH). Cela le rend capable de former des liaisons dites bidentées avec de nombreux supports. C'est comme si cet acide aminé avait deux mains pour s'accrocher fermement n'importe où.
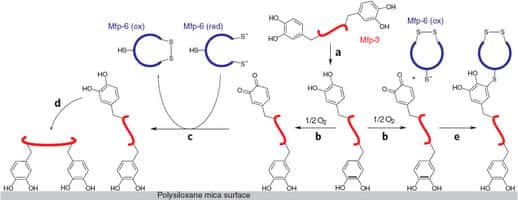
Lorsque la moule veut s'accrocher à un support (ici une plaque de mica en gris), elle produit (a) la protéine mfp-3 (en rouge). Celle-ci contient plusieurs acides aminés « Dopa » (les hexagones) dont les groupements OH sont oxydés (b) par l'oxygène du milieu. Pour éviter cela et permettre la fixation, la moule libère la protéine mfp-6 (en bleu). L'oxydation de ses groupements thiols (S-), couplée à la réduction de la Dopa, annule cet effet (d) et la mfp-6 oxydée peut se fixer à son tour sur la mfp-3 (e). © Nature Chemical Biology
Le problème est qu'en mer, d'autant plus en zone côtière où les vagues mélangent fortement l'airair à l'eau, le milieu est riche en oxygène. Or celui-ci occupe les « mains » de la Dopa et l'empêche de s'accrocher : plus précisément, l'oxygène oxyde immédiatement les Dopa non fixés en Dopa-quinone ne possédant plus les groupes OH. Ce qui limite donc fortement le nombre de points d'ancrage des mfp-3 et mfp-5.
Une protection sur mesure
Pour remédier à cela, la moule a une solution : la sécrétionsécrétion d'une seconde protéine, la mfp-6. En milieu acide, elle va annuler l'effet de l'oxygène grâce à ses groupes réactifsréactifs soufrés appelés « thiols ». Ceux-ci vont agir sur la Dopa pour lui permettre de retrouver ses deux groupes hydroxyles (ses petites mains) et donc aux mfp-3 et mfp-5 de conserver leurs capacités de fixation.
Pour les chimistes, c'est un couplage entre l'oxydationoxydation des groupes thiols de la mfp-6 et la réduction de la Dopa-quinone. La mfp-6 paye son intervention en étant oxydée. Mais sous cette forme, elle va pouvoir se lier à la Dopa par l'intermédiaire d'un atomeatome de soufresoufre (pont monosulfure). Une forme de réticulationréticulation qui va renforcer la cohésion de l'ensemble final.
Une fois de plus, la nature offre aux ingénieurs des idées pour de nouvelles technologies. L'utilisation par la moule d'une moléculemolécule protectrice pour permettre à une seconde molécule de jouer son rôle de façon optimale est un procédé qui pourrait être réemployé pour développer de nouveaux produits biomimétiques. Des supercolles par exemple, efficaces dans les milieux les plus difficiles. Mais l'étude ouvre aussi la voie à de nouvelles techniques, visant à limiter le fouling (l'encrassement des coques de bateaux par les organismes marins) avec des produits moins toxiques ciblant spécifiquement le mécanisme de fixation des mollusques.