au sommaire
Les Atomes
Intéressons-nous à l'atome. De quoi est-il fait ? Quelle est sa forme ? Quelle est sa masse ?

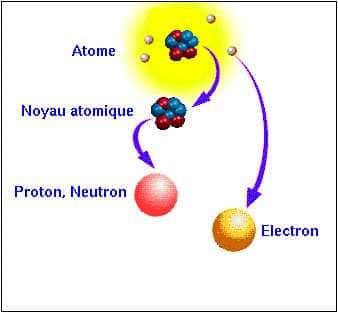
Constitution d'un atome (échelle non respectée). © DR
De quoi est fait un atome ?
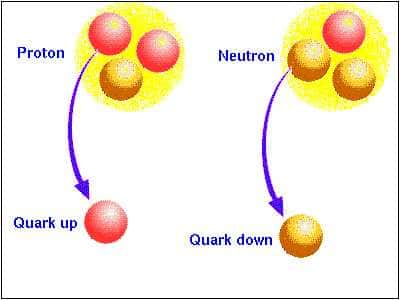
Un atome contient un noyau situé en son centre et des électrons qui « tournent » autour du noyau. Le noyau contient des nucléons, c'est-à-dire des protons et des neutrons.
Les électrons ont une charge électrique négative. Les protons ont une charge électrique positive, de même valeur que celle de l'électron. Les neutrons n'ont pas de charge électrique, ils sont neutres.
Il y a exactement le même nombre d'électrons et de protons dans un atome, un atome est donc électriquement neutre. Le nombre d'électrons (ou de protons) dans un atome détermine ses propriétés physiquesphysiques et chimiques, c'est le nombre atomique. Par exemple, un atome d'hydrogènehydrogène a 1 électron et 1 proton, le nombre atomique d'un atome de carbonecarbone est 6, celui d'un atome d'oxygèneoxygène 8, d'un atome de ferfer 26, d'un atome d'uraniumuranium 92, etc. (voir la table des éléments)
Le nombre de neutrons dans un atome est variable, en général il est proche du nombre de protons. Deux atomes de même nombre atomique mais ayant un nombre de neutrons différents sont des isotopesisotopes : leurs propriétés chimiques sont identiques mais leurs propriétés physiques sont différentes (par exemple, certains isotopes d'atomes stables sont radioactifs). Pour différencier les isotopes entre eux, on donne en général le nombre de nucléons avec le nom de l'atome. Par exemple, l'uranium 235 contient 92 protons et 143 neutrons (235=92+143) et l'uranium 238 contient 92 protons et 146 neutrons (238=92+146).
Un peu d'histoire
Notre connaissance des atomes est très récente. En effet, la structure des atomes était totalement inconnue en 1895 ! C'est la découverte des rayons Xrayons X par Röntgen en 1895 puis de la radioactivité par Henri BecquerelHenri Becquerel en 1896 et Pierre et Marie CurieMarie Curie à partir de 1898 qui a permis de commencer à comprendre la structure des atomes.
Les électrons ont été identifiés par J.- J. Thomson en 1897, puis, en 1911, Ernest RutherfordErnest Rutherford découvre l'existence du noyau atomique. Cependant, pendant plusieurs années, les physiciensphysiciens pensaient que le noyau était formé de protons et d'électrons. Dans le même temps, pendant les années 1924-1927, le développement de la mécanique quantiquemécanique quantique permet de décrire de manière précise le comportement des électrons des atomes. Seul le noyau restait incompris...
En 1931, Irène et Frédéric Joliot-CurieFrédéric Joliot-Curie observent les neutrons mais sans comprendre leur nature. En 1932, James Chadwick montre que le neutron est un partenaire neutre du proton. La structure de l'atome est comprise...
Qu'est-ce qui lie les électrons au noyau ?
Les électrons et le noyau d'un atome sont liés par l'interaction électromagnétique. En effet, le noyau atomique a une charge électrique positive, grâce aux protons, alors que les électrons ont une charge électrique négative. Ainsi, parce que leurs charges électriques sont opposées, le noyau atomique et les électrons s'attirent, ce qui permet aux atomes de ne pas perdre leurs électrons.
Lorsque deux atomes sont suffisamment proches l'un de l'autre, ils peuvent échanger certains de leurs électrons, cet échange permet alors de lier ces deux atomes en un objet composite qui est une moléculemolécule. Ce processus est une réaction chimiqueréaction chimique.
Que signifie le mot atome ?
Le mot atome vient du grec atomos qui signifie indivisible, insécable. Il convenait donc parfaitement au concept d'atome lorsqu'il a été élaboré par les chimistes au début du XIXe siècle, c'est à dire comme la plus petite partie d'un corps purcorps pur.
Maintenant, on sait que les atomes ne sont pas indivisibles, qu'on peut en arracher des électrons, fissionner leur noyau, etc. Mais le nom est resté !
Qu'est-ce qu'un ion ?
Un ionion est un atome ou une molécule dont on a enlevé ou ajouté un ou plusieurs électrons. Ainsi, un atome ou une molécule étant toujours électriquement neutre, un ion est soit positif soit négatif. Un ion a donc des propriétés physicochimiques différentes de la molécule dont il provient. Un ion positif est appelé un cationcation et un ion négatif est appelé un anionanion.
L'ionisationionisation de la matièrematière consiste à arracher des électrons aux atomes. La grande majorité des systèmes de détection des particules est basée sur l'ionisation.
Quelle est la taille d'un atome ?
Un atome a une taille de l'ordre de 10-10m, soit un dixième de millionième de millimètre ! Un noyau d'atome a une taille de l'ordre de 10-15 m, soit cent mille fois plus petit que l'atome lui-même !
Un électron est théoriquement une particule ponctuelle, elle ne doit donc pas avoir de taille... En tout cas, si l'électron a une taille, elle est inférieure à 10-18m, soit au moins cent millions de fois plus petit que l'atome !
Un atome est donc très petit : il y a onze milliards de milliards d'atomes de fer dans un milligramme de fer !
Quelle est la masse d'un atome ?
La massemasse d'un nucléon est de 1,7 10-27 kgkg, soit moins de deux millièmes de milliardième de milliardième de milligramme ! Les protons et les neutrons ont quasiment la même masse.
La masse d'un électron est de 9,1 10-31 kg, soit 1.836 fois moins qu'un nucléon !
Ainsi, 99,97 % de la masse d'un atome est dans son noyau !
Comme le noyau est très petit, la masse d'un atome est donc très concentrée. Ainsi, si on supprimait le vide qu'il y a autour des noyaux des atomes, la Terre pourrait tenir dans une sphère de seulement 150 m de rayon !
À quoi ressemble un atome ?
Si on grossit mille milliards de fois un atome d'hydrogène :
- le noyau est constitué d'un seul proton, il a une taille de 1 millimètre et a une masse de 1,7 million de tonnes !
- l'unique électron a une taille inférieure à 1 micronmicron (un millième de millimètre) et a une masse de 900 tonnes !
- cet électron « tourne » autour du noyau dans un volumevolume d'environ 100 m de diamètre, c'est la taille de cet atome d'hydrogène, tout le reste est vide !
Un atome est-il vide ?
Le volume du noyau est un million de milliards de fois plus petit que celui de l'atome. Le volume de l'atome est donc défini comme le volume dans lequel on a une chance non négligeable de trouver un des électrons de cet atome.
Le volume de l'atome est donc constitué d'au moins 99,9999999999999 % de vide !
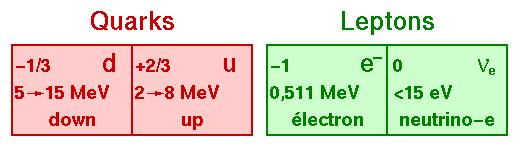
En théorie, les particules qui forment les protons et les neutrons (les quarksquarks) sont, tout comme l'électron, des particules ponctuelles, c'est-à-dire des particules sans volume. En théorie, un atome est donc constitué de 100 % de vide ! Il n'est bien sûr pas possible de prouver que c'est vrai...