au sommaire
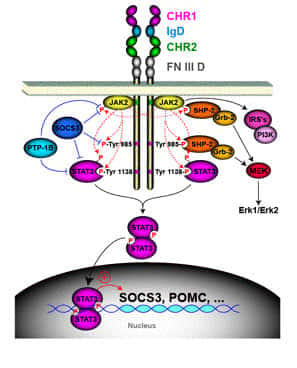
Le récepteur de la leptine et son rôle dans le développement de l’obésité
L'obésitéobésité est aujourd'hui considérée comme une menace majeure de santé publique, fréquemment et étroitement associée à des complications graves (diabètediabète de type II, maladies cardiovasculairesmaladies cardiovasculaires, cancercancer...)). L'obésité touche aujourd'hui 20 à 30 % de la population dans les pays industrialisés et ces chiffres devraient encore croître dans les années à venir.
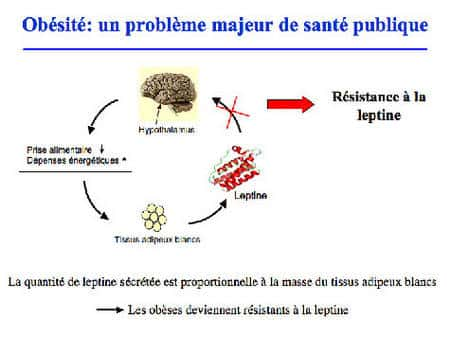
L'obésité est souvent liée à un déficit de sensibilité à une hormonehormone, la leptineleptine. La leptine est principalement sécrétée par le tissu adipeux blanctissu adipeux blanc et agit au niveau du cerveaucerveau (noyau arqué de l'hypothalamushypothalamus) pour réguler les dépenses énergétiques et la prise alimentaire.

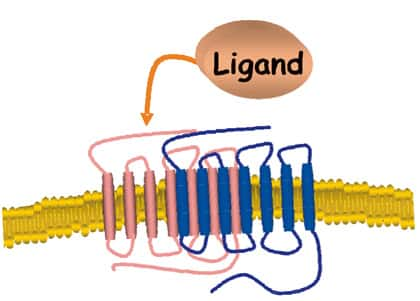
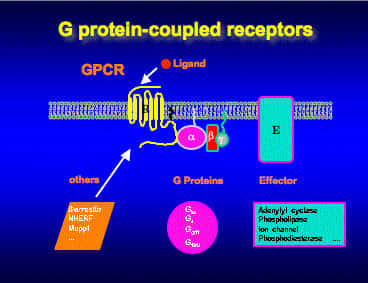
Pour propager son action, la leptine doit interagir et activer son récepteur (OB-R), conduisant au déclenchement de multiples voies de signalisation (Jak2/STAT3, MAPK, PI3K, AMPK). Des mutations génétiquesgénétiques altérant l'expression de la leptine ou de son récepteur, sont des causes d'obésité massive chez la souris et chez l'homme. Cependant, ces mutations sont très rares. Dans la majorité des cas, les malades obèses présentent paradoxalement des taux de leptine circulante élevés qui sont incapables d'induire une réponse adéquate. Cet état pathologiquepathologique est appelé "résistancerésistance à la leptine". La résistance à la leptine peut être le résultat soit d'une déficience du transport de l'hormone à travers la barrière hémato-encéphaliquebarrière hémato-encéphalique, soit d'un défaut de signalisation du récepteur ou d'une altération du nombre de récepteurs à la surface cellulaire.
1 - De nouveaux composés régulant l’activité du OB-R
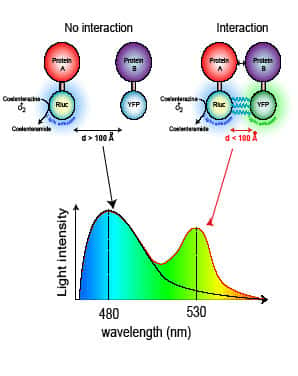
En utilisant la technologie BRET, notre équipe a montré que l'OB-R est un oligomère préformé qui subit un changement de conformationconformation suite à la liaison du ligand. En effet, on peut détecter une augmentation du signal BRET lors du changement de conformation du récepteur, où la luciférase fusionnée à l'un des protomères du récepteur transmet son énergie à la YFP fusionnée au second protomère.
Nous cherchons à identifier et caractériser de nouvelles molécules capables d'intervenir au niveau de l'activation de l'OB-R. Des molécules qui activent l'OBR différemment de la leptine pourraient soit réactiver des récepteurs résistants à la leptine, soit potentialiser la réponse faible de la leptine par un mode d'action allostérique. De tels composés pourront constituer de nouvelles solutions thérapeutiques puissantes notamment dans le traitement de la résistance à la leptine. Nous utilisons notre test de BRET qui a été adapté aux besoins des cribles à haut débitdébit.

Suivi de l'activation d'OB-R par BRET : (A) Description de la technique de BRET. (B) Effet de différentes droguesdrogues sur le signal de BRET. (C) Test de criblage de ligands interagissant avec OB-R basé sur la technique de BRET.
2 - Analyse moléculaire des modifications épigénétiques induites par une malnutrition précoce : effet sur le développement de maladies métaboliques chez l'adulte.
Dans les pays occidentaux, les maladies métaboliques (dérégulation de l'homéostasiehoméostasie glucidique, hypertensionhypertension, maladies cardiovasculaires...) prennent des allures épidémiques et se développent de plus en plus à un âge très précoce. Des données épidémiologiques et expérimentales montrent que des « stimuli » nutritionnels très précoces (avant la naissance et pendant les premières années de la vie) conditionnent le développement de maladies métaboliques à l'âge adulte. Cette « programmation nutritionnelle » peut être transmise d'une génération à l'autre. Il semble donc que des modifications épigénétiques soient impliquées dans ces processus de programmation précoce. Le but de notre projet est d'identifier, au niveau moléculaire, les mécanismes associés à la programmation nutritionnelle précoce et qui entraînent le développement de pathologiespathologies chroniques chez l'adulte.
Notre projet sera centré sur la méthylationméthylation de l'ADNADN, qui apparaît être un mécanisme clés pour la transmission des modifications épigénétique entre les générations.