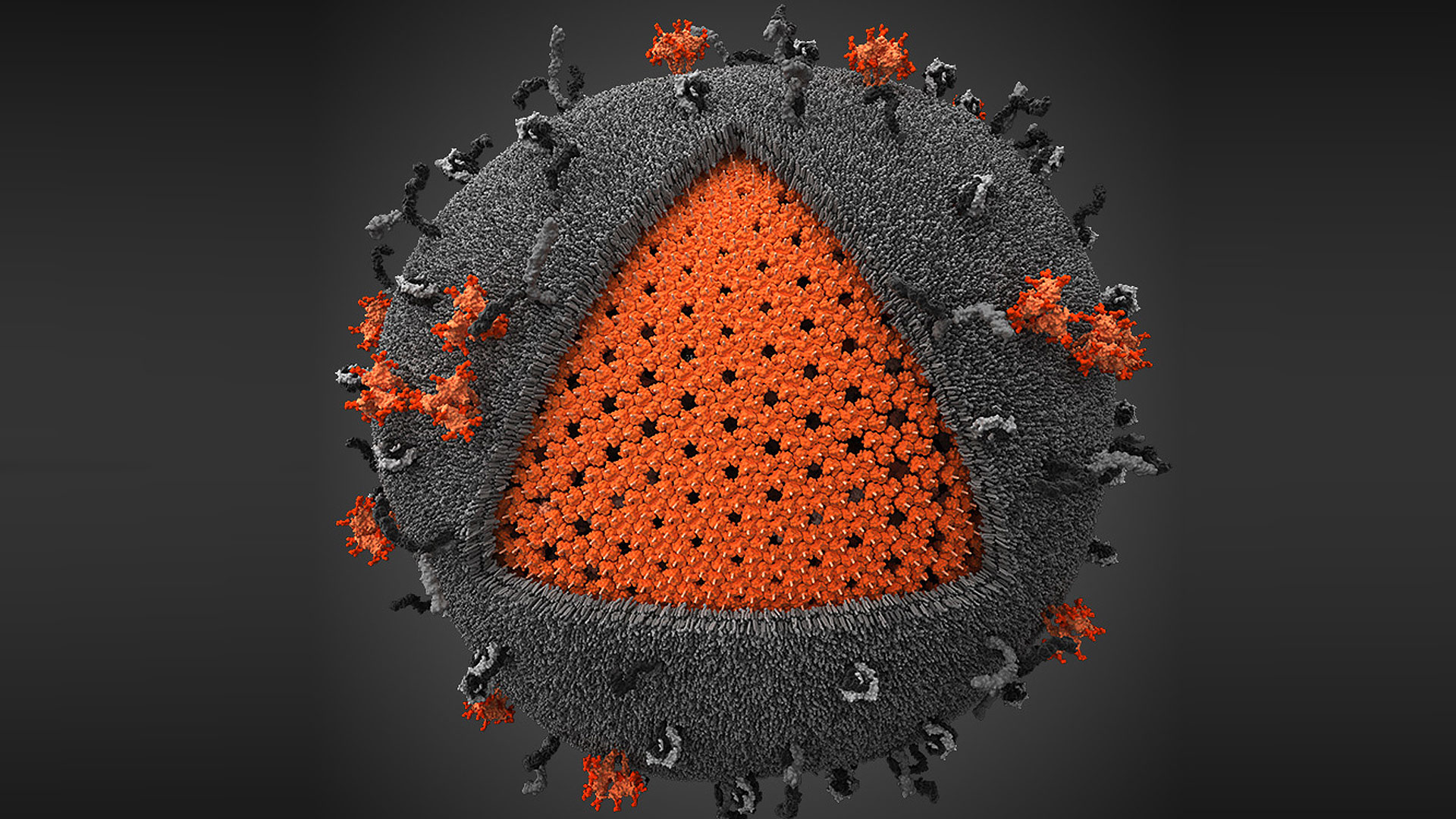
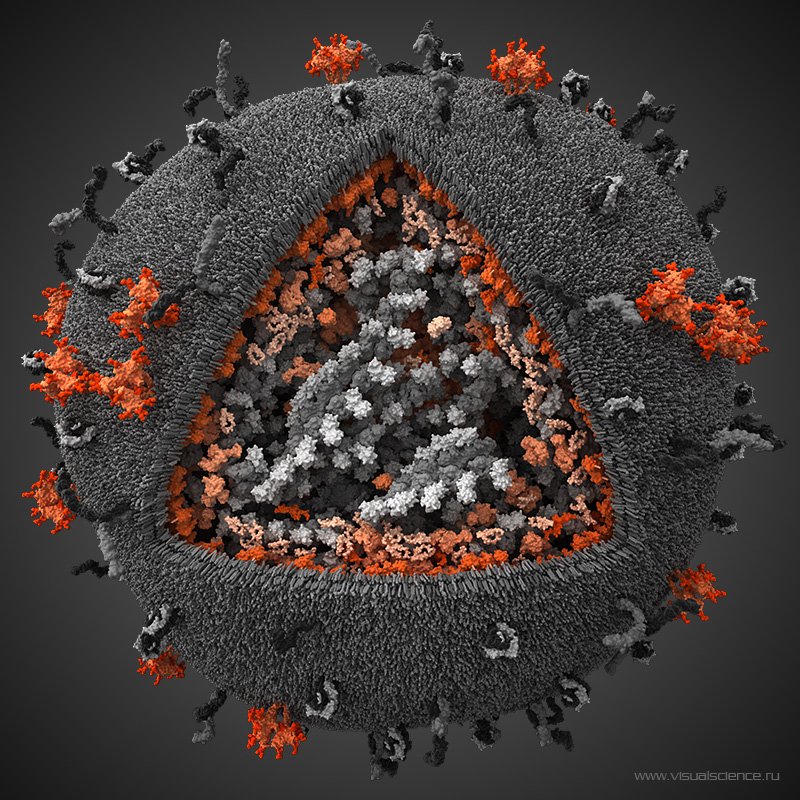
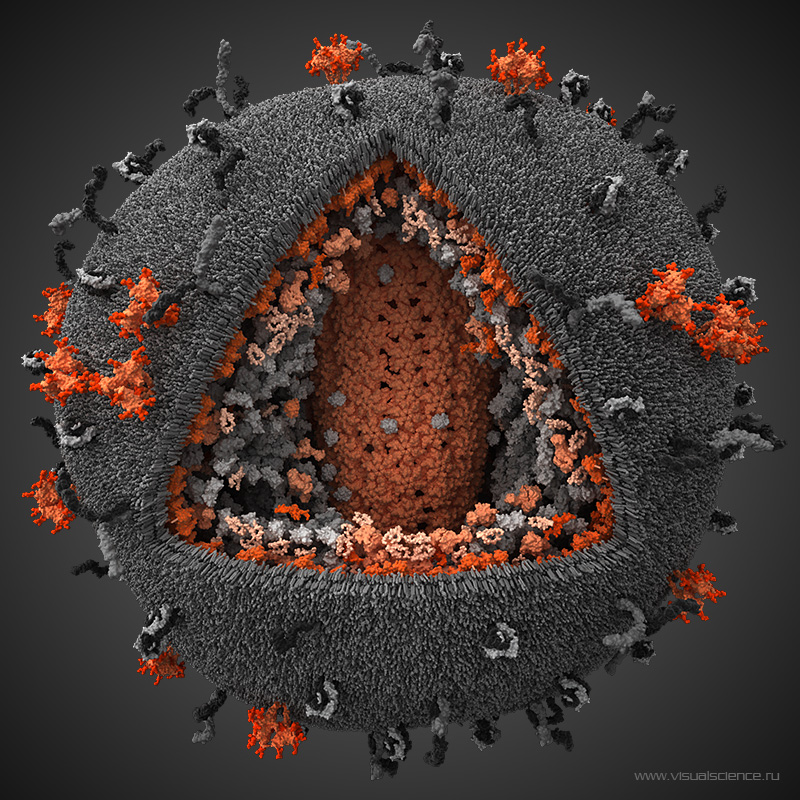
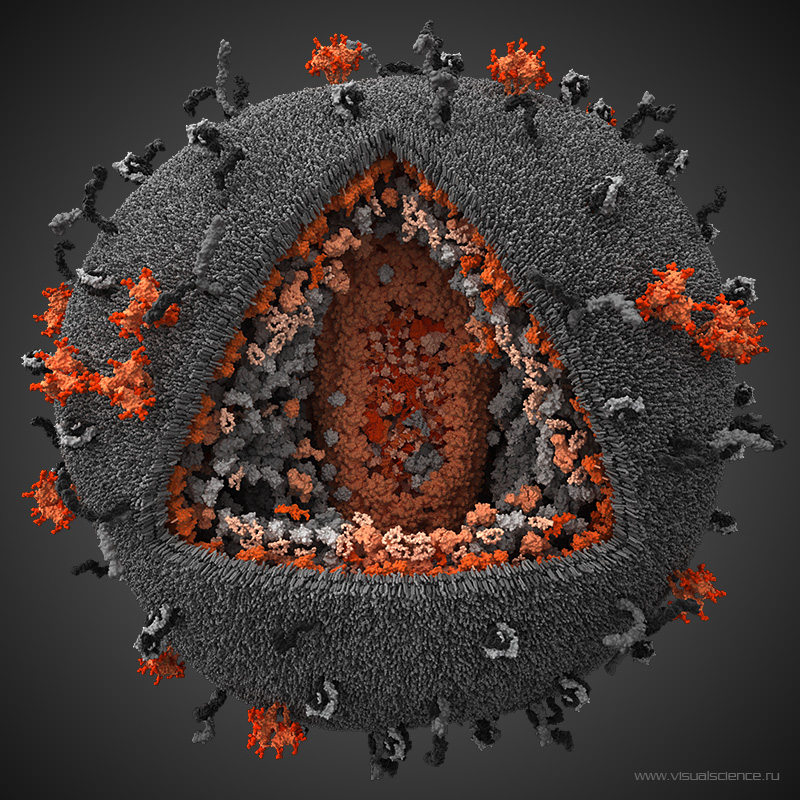
Une mère séropositive pour le VIH qui s'ignore peut contaminer son enfant lors de sa grossesse mais après également, en l'allaitant. Les risques de mourir du Sida sont accrus pour les enfants contaminés jeunes car le virus crée des réservoirs dans les cellules qui échappent aux traitements. À l'université de Portland, des chercheurs ont établi un protocole thérapeutique qui permettrait d'empêcher la formation des réservoirs chez de jeunes singes.
au sommaire
La transmission de la mère à l'enfant du virus de l’immunodéficience humaine (VIH) est la première cause de contamination des jeunes enfants. Une femme séropositiveséropositive peut transmettre le virus à son enfant lors de la grossesse mais aussi pendant l'accouchement et l'allaitement. En 2017, 180.000 enfants de moins de quinze ans ont été infectés par le VIHVIH dans le monde, selon l’Unaids. Grâce aux traitements et un suivi médical poussé, le risque de passage du VIH de la mère à l'enfant est de moins de 1 % en France.
Néanmoins pour que le traitement soit efficace, il faut agir vite. L'une des caractéristiques du VIH est la création de réservoirs persistants dans les lymphocytes T4. À l'abri dans les cellules, le virus n'est pas touché par les traitements et même si la virémievirémie baisse, il peut à tout moment bourgeonner des cellules et infecter de nouveaux lymphocyteslymphocytes si le traitement est arrêté.
Une équipe de chercheurs américains affiliée à l'université de Science et de Médecine de Portland propose deux protocolesprotocoles thérapeutiques qui empêchent la formation de réservoir viral. Une dose unique d’anticorps neutralisants trente heures après le contact avec le virus ou un traitement antirétroviral, débuté 48 heures après l'infection et étendu pendant 21 jours, protège des singes nouvellement nés. Leur travail a fait l'objet d'une publication dans Nature Communications.
Un double-traitement pour protéger les nourrissons du VIH
Les chercheurs ont réalisé leur protocole sur des jeunes macaques infectés par voie orale par le HIV-1 (la forme simienne du virus pour les singes) à l'âge d'un mois. Le premier traitement est basé sur une dose unique d'anticorpsanticorps neutralisant, c'est-à-dire bloquant l'entrée du virus dans les cellules immunitaires. Ces anticorps neutralisants sont spécifiques du même site de fixation que l'enveloppe du VIH sur le CD4. Une injection d'anticorps neutralisant moins de trente heures après l'infection protège efficacement les jeunes singes. La virémie est limitée et il n'y a pratiquement pas de virus cachés dans les cellules.
“Les scientifiques y voient un grand potentiel”
Dans le cas du deuxième traitement, un cocktail de cinq molécules antirétrovirales (emtricibatine, tenofovir, disoproxil fumaratefumarate et dolutegravir) a été administré 48 heures après l'infection et poursuivit pendant 21 jours, les résultats sont aussi positifs. Son action est rapide et prévient la réplicationréplication et la dissémination du virus. Les scientifiques ont contrôlé l'évolution du virus chez les jeunes singes pendant 24 semaines. Dans les deux cas, la concentration du virus dans le sang ou dans les cellules n'a pas augmenté. Ces résultats montrent que les deux traitements préviennent les rechutesrechutes dans une fenêtrefenêtre de six mois.
D'autres recherches sont à mener pour éprouver l'efficacité de ce traitement, notamment sur des singes juste après leur naissance, mais les scientifiques y voient un grand potentiel. Une thérapiethérapie combinant ces deux protocoles pourrait s'avérer efficace chez les nourrissons contaminés via le lait maternellait maternel d'une mère séropositive qui s'ignore.