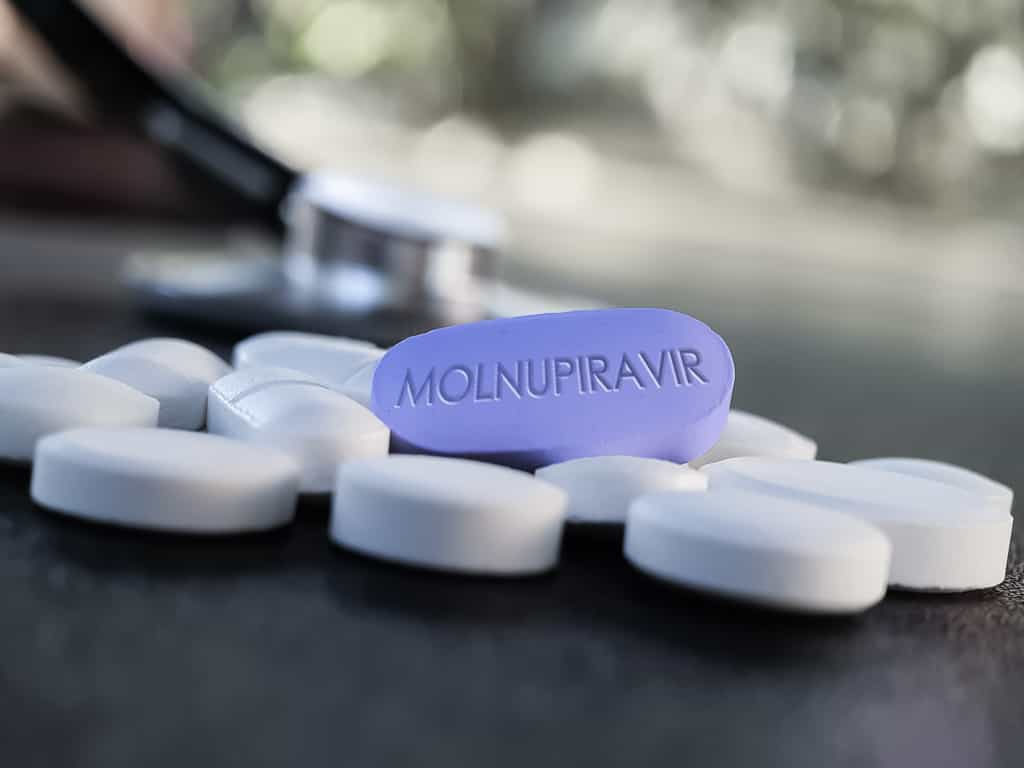
La gélule Molnupiravir a été codéveloppée par deux entreprises américaines, le laboratoire Merck & Co et la biotech Ridgeback Biotherapeutics, sous le nom commercial Lagevrio. C’est pourtant au Royaume-Uni, qui avait également été le premier pays à approuver un vaccin, qu’elle obtient sa première autorisation de mise sur le marché.
au sommaire
Après analyse du dossier fourni par le fabriquant, la Medecines and Healthcare Products regulatory Agency (MHRA) a annoncé le jeudi 4 novembre que le traitement oral molnupiravir était « sûr et efficace ». Des demandes auprès de la Food and Drug AdministrationFood and Drug Administration (FDA) aux USA et auprès de l'European Medecines Agency sont en cours d'examen. Les USA devraient donner leur réponse le 30 novembre.
Les essais cliniques sur le molnupiravir ont montré sa capacité à diminuer le risque d’hospitalisations, quel que soit le variant. Éviter la saturation dans les services hospitaliers : c'est tout l'enjeu des politiques de santé menées par la plupart des pays dans le monde.
Avec la remontée du virus en France ces dernières semaines, faut-il s'attendre à un reconfinement cet hiver ? © Futura
Un traitement précoce pour les patients à risque
Ce médicament est le premier traitement par voie orale contre la Covid-19. Contrairement aux cocktails d’anticorps déjà disponibles, ce médicament peut être prescrit en ville et administré hors de l'hôpital. Il est indiqué dans les formes légères à modérées, chez l'adulte présentant au moins un facteur de risque de faire une forme grave de la maladie (diabète, obésitéobésité, maladie cardiaque, personnes de plus de 60 ans...)).
Il doit être administré le plus tôt possible, dans les cinq premiers jours après le début des symptômessymptômes. La posologie est de 800 mg deux fois par jour pendant cinq jours.
Le laboratoire avait démarré la production avant l'autorisation et déclare être en mesure de fournir 10 millions de schémas thérapeutiques complets d'ici fin 2021. La France a, pour sa part, précommandé 50.000 doses de ce traitement. Avec la recrudescence du nombre de cas ces derniers jours en France, toute arme supplémentaire dans la lutte contre la pandémiepandémie est la bienvenue.