au sommaire

Note : les Bulletins Electroniques (BE) sont un service ADIT et sont accessibles gratuitement sur www.bulletins-electroniques.com
Des résultats publiés dans la revue NeuronNeuron du 2 mars soutiennent la première des deux options. Dans l'article, des chercheurs de l'Université de Californie à Irvine et de l'Institut de recherche biologique de Ness-Ziona en Israël montrent que cibler les plaques amyloïdes constitue une approche valide pour traiter la maladie d'Alzheimer.
Ces résultats font suite à des travaux plus anciens suggérant que les plaques amyloïdes causent des enchevêtrements neurofibrilaires et qu'ensemble ils sont à l'origine de déficits cognitifs associés à la maladie.
L'étude utilise des souris transgéniquestransgéniques modèles de la maladie (surexpression de formes mutantes de l'APP humaine -Amyloid Precusor Protein- et de la protéine tau et intégration d'un gène mutant de la presenilin-1). Les chercheurs montrent qu'un agoniste d'un sous-type du récepteur spécifique de l'acétylcholineacétylcholine (M1M1) réduit les plaques amyloïdes et les enchevêtrements de la protéine tau dans des régions du cerveaucerveau associées à l'apprentissage et à la mémoire. Le traitement reverse certains déficits cognitifs des souris transgéniques.
D'autres agonistes du récepteur M1 ont déjà échoué dans des études cliniquesétudes cliniques. Les chercheurs californiens et israéliens pensent que leur moléculemolécule fonctionne grâce à un meilleur passage de la barrière hémato-encéphaliquebarrière hémato-encéphalique, une plus grande sélectivité au récepteur M1, une meilleure bio-disponibilité et une plus large fenêtrefenêtre de sécurité.
L'entreprise de biotechnologiebiotechnologie TorreyPines Therapeutics basée à San Diego, a annoncé la semaine dernière le lancement d'une étude clinique multi-dose de Phase I après avoir montré la bonne tolérance du composé dans une première étude simple dose.
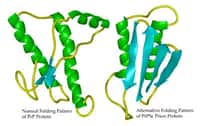
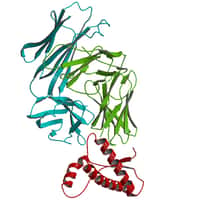
Deux articles publiés dans la revue Nature Structural and Molecular Biology, essaient de comprendre les facteurs à l'origine de la formation des plaques amyloïdes. Les deux études à Yale et à l'Université de Leeds en Grande-Bretagne utilisent comme modèle la protéine bêtabêta-2-microglobulin, B2M, qui forme des plaques dans la genèse de l'amyloseamylose du dialysé.
Les deux études identifient une prolineproline spécifique au sein du squelette moléculaire de la protéine dont la conformation joue un rôle dans la formation des plaques. Les chercheurs de Yale montrent par cristallographiecristallographie à rayons Xrayons X que, quand B2M se lie à un atomeatome de cuivrecuivre, la proline en question peut changer d'état, d'une conformation Trans à une conformation Cis. ' C'est un changement assez radical pour le squelette de la molécule' note Dr Miranker auteur des travaux. Il est même surprenant que la protéine entière ne perde pas toute structure'.
Au lieu de cela, le changement de conformation se propage dans la molécule et permet à deux feuillets bêta de former une liaison asymétriqueasymétrique. Ces feuillets montrent alors un côté hydrophobehydrophobe qui peut permettre un assemblement avec d'autres feuillets, entraînant la formation de plus longues fibres amyloïdes. Le cuivre a deux rôles, celui de catalyser le changement conformationnelchangement conformationnel et celui d'agir de façon transitoire, comme lien entre deux feuillets bêta.
Le groupe de Leeds a utilisé une série d'études de repliements et dépliements sous différentes conditions pour trouver que des fibres amyloïdes se forment quand une proline spécifique change son état d'une conformation Cis à Trans. Les chercheurs suggèrent que, même si la forme Trans est une conformation à haute énergieénergie et donc rare dans la nature, les fibres peuvent toutefois se former quand la concentration en protéines amyloïdes est élevée comme c'est le cas dans l'amylose du dialysé.
Par Peggy Rematier