au sommaire
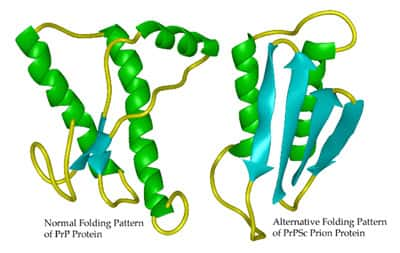
changement de conformation de la protéine Prp (prion). La forme de gauche est la forme non pathogène, la forme de droite est la forme pathogène.Crédit: Whitehead Institute
La MCJ existe sous trois formes; la plus récente est appelée le nouveau variant de la MCJ et serait liée à la présence d'un agent pathogène d'un nouveau genre : le prion. Le prion n'est ni une bactérie, ni un virus, il s'agit juste d'une protéine présente dans nos cellules (les neuronesneurones en particulier). Cette protéine a la capacité de pouvoir changer de conformationconformation, passant ainsi d'une forme normale non pathogène (PrpC)), à une forme modifiée pathogène (PrpSC). Ce qu'il y a probablement de plus remarquable, outre ce changement de conformation, est la capacité de la protéine PrpSC à transmettre cette nouvelle conformation aux autres protéines PrpC. Ainsi la PrpSC envahit petit à petit les cellules nerveuses et est transmissible aux cellules filles après division.
Le mécanisme par lequel la protéine PrpC tue les neurones demeure encore largement incompris, cependant l'équipe de Suzan Lindquist aux Etats-Unis a montré que l'accumulation de la protéine Prp dans le cytoplasmecytoplasme des neurones provoquait très rapidement la destruction de ces derniers, avant même que la protéine Prp n'ait le temps de changer de conformation. Dans les conditions normalesconditions normales, la protéine Prp est très rapidement dégradée par un complexe protéique appelé le protéasome.
L'ESBESB se caractérise par la formation de " plaques amyloïdesplaques amyloïdes " dans le cerveaucerveau, donnant à celui-ci un aspect d'éponge (d'où son nom). Jusqu'à présent, le seul moyen de confirmer la MCJ était d'effectuer une biopsiebiopsie du cerveau de la personne décédée. Aucune technique ne permettant la mise en évidence du prion sur une personne vivante. La technique développée par l'équipe de chercheurs Suisse, permet une grande avancée puisqu'il est dorénavant possible par une biopsie du muscle de détecter la présence du prion. En effet, les chercheurs ont mis en évidence la présence du prion dans les tissus musculaires et la raterate de certains patients décédés de MCJ. Cependant le prion n'a pas été détecté chez tous les patients, et il semble que la présence du prion dans les tissus non neuronaux soit liée à un variant moléculaire peu fréquent responsable de la MCJ, et à une duréedurée d'incubation de la maladie beaucoup plus longue.
Faut-il craindre une transmission par la viande ?
Tout d'abord il n'est jamais inutile de rappeler qu'il n'existe à l'heure actuelle aucune preuve d'une transmission directe du prion de la vachevache à l'homme. Les expériences réalisées en laboratoire ont montré qu'il était possible d'infecter des souris à partir de prions bovins, en injectant le prion concentré directement dans le cerveau des souris. Autant dire que nous sommes loin des conditions de contaminationcontamination éventuelles que nous rencontrons en mangeant de la viande.
La présence de prions dans les muscles de la souris avait déjà été rapportée suite à des infections expérimentales, en revanche il n'a jamais été possible de mettre en évidence les particules infectieuses dans les muscles de la vache. On ne sait pas si cette différence est liée au niveau de sensibilité des techniques, ou si les vaches meurent avant d'avoir accumulé le prion dans leurs tissus musculaires.
Les chercheurs indiquent que les concentrations de prion trouvées dans les muscles sont mille fois inférieures à celles présentes dans le cerveau. Or il est bien établi qu'il faut un atteindre un certain seuil avant que les protéines PrpSC n'arrivent à se répandre dans les cellules. Autrement dit, il semble que les concentrations de prions dans les tissus musculaires soient bien trop faibles pour pouvoir être dangereuses.
Cette nouvelle technique va donc permettre une meilleure détection des prions dans la viande, mais aussi permettre un diagnostique précoce de la maladie chez l'homme. Malheureusement, il n'existe encore aucun moyen thérapeutique pour soigner cette maladie.