au sommaire

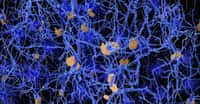
Accumulation sous forme de batonnets de la proteine prion (PRPSc) dans le cerveau d'un enfant atteint de creutzfeldt-jacob iatrogene Crédit: Fournier J.G. INSERM
Les maladies à prions sont des encéphalopathies spongiformes. Elles incluent la maladie de la vache follemaladie de la vache folle, la tremblante du moutontremblante du mouton, ou encore la nouvelle variante de la maladie de Creutzfeld-Jacob (vCJD). Toutes ces maladies sont actuellement incurables.
Le cerveau des malades infectés est rempli de trous causés par la destruction des neurones. Ces cerveaux contiennent aussi des agrégats d'une protéine (la PrP) ayant une conformation anormale nommée PrPSc.
La forme PrPSc de la protéine est supposée être l'agent infectieux de la maladie, mais ne semble pas être directement responsable de la mort des neurones.
Tous les mammifèresmammifères, incluant l'homme, synthétisent la protéine PrP. Après sa synthèse, la protéine est acheminée vers la membrane cellulairemembrane cellulaire, puis exposée à la surface des cellules. Le rôle physiologique de la protéine PrP demeure toujours incertain.
Comme pour toutes protéines, il peut se produire une erreur lors de la synthèse entraînant alors une mauvaise conformation spatiale. Cette protéine inactive est alors éliminée par un complexe enzymatiqueenzymatique appelé le protéasome. L'équipe du Pr Yiyan Ma de l'université de l'Ohio (USA) a démontré que la protéine sous sa forme PrPSc semble saturer ce mécanisme de contrôle de la qualité des protéines. Une fois le mécanisme saturé les protéines PrPSc s'accumulent dans la cellule et la détruit. Cependant ces travaux ne donnent aucune indication sur la manière dont la protéine PrPSc sature l'activité du protéasome. Une des hypothèses étudiées est qu'elle modifierait une voie de signalisation cellulaire.
Ces résultats permettent d'envisager de nouvelles approches thérapeutiques en utilisant des droguesdrogues stimulant l'activité du protéasome. L'équipe américaine a d'ailleurs montré que l'utilisation de drogues inhibant l'activité du protéasome provoquait une accumulation de protéines mal conformées qui finissait par être toxique pour la cellule.
Or des inhibiteurs du protéasome sont actuellement en essai cliniqueessai clinique pour soigner des maladies telles que le cancercancer. Les travaux de l'équipe du Pr Ma indiquent qu'il faut être prudent dans l'utilisation de ces drogues, spécialement chez les personnes ayant pu être en contact avec la protéine PrPSc, afin de ne pas augmenter le risque que ces personnes développent la vCJD.
Jusqu'à présent, 117 personnes sont mortes en Angleterre de la vCJD. Les prédictions épidémiologiques indiquent qu'entre une centaine et un millier de personnes sont infectées. Le principal problème pour la mise au point d'un traitement est la très longue période d'incubation des maladies à prions. Lorsque les premiers symptômessymptômes apparaissent de nombreux neurones ont déjà été détruits.
Par OlivierOlivier Namy - Futura-Sciences UK