au sommaire
Les synapses sont les connexions nerveuses entre les neurones, et nous sont indispensables. Malheureusement, elles disparaissent progressivement dans la maladie d'Alzheimer, contribuant à l'accélération du déclin cognitif. La faute aux oligomères de bêta-amyloïdes. © Emily Evans, Wellcome Images, Flickr, cc by nc nd 2.0
La population mondiale vieillit et doit désormais faire face à des pathologies autrefois méconnues. Parmi elles, les démences, la maladie d’Alzheimer en tête. On célèbre ce 21 septembre la 20e journée mondiale de lutte contre la neurodégénérescence la plus commune. Elle se caractérise par la perte progressive de synapses et de neurones dans le cerveau des patients, se traduisant en retour par des déficits cognitifs, notamment en ce qui concerne la mémoire.
Fréquente et coûteuse pour la société, elle fait l'objet de nombreuses recherches depuis des années, mais elle garde encore son lot de mystères. Par exemple, on ignore ses causes exactes. On sait qu'elle a une composante génétique, que l'hygiène de vie peut la limiter, et qu'on trouve dans le cerveau de tous les patients des agglomérats de protéines appelées bêta-amyloïdesbêta-amyloïdes, formant ce que l'on appelle des plaques séniles.
Mais ces bêta-amyloïdes sont-ils la cause ou la conséquence de la maladie d'Alzheimermaladie d'Alzheimer ? Le débat n'avait pas été réellement tranché, même si les suspicions de culpabilité étaient fortes. De nouveaux éléments publiés dans Science plaident en la défaveur de ces protéines : elles contribueraient à la destruction des synapses, les connexions nerveuses.
Des bêta-amyloïdes qui ont trop d’affinités avec PirB
Quelques précisions s'imposent pour comprendre précisément la recherche. Carla Shatz, chercheuse à l'université Stanford, travaille depuis plusieurs années sur une protéine de souris nommée PirB. Alors qu'on la pensait limitée au système immunitairesystème immunitaire, cette protéine se retrouve également à la surface des neuronesneurones, à proximité des synapses. Elle constitue un frein en empêchant les connexions nerveuses d'établir des liens trop forts à chaque nouvelle stimulationstimulation, et évite l'hyperexcitabilité menant notamment à l'épilepsieépilepsie. Mais il s'avère que des souris génétiquement modifiées pour présenter des troubles similaires à ceux rencontrés dans la maladie d'Alzheimer ne présentent pas cette plasticitéplasticité synaptique. PirB y serait-elle pour quelque chose ?
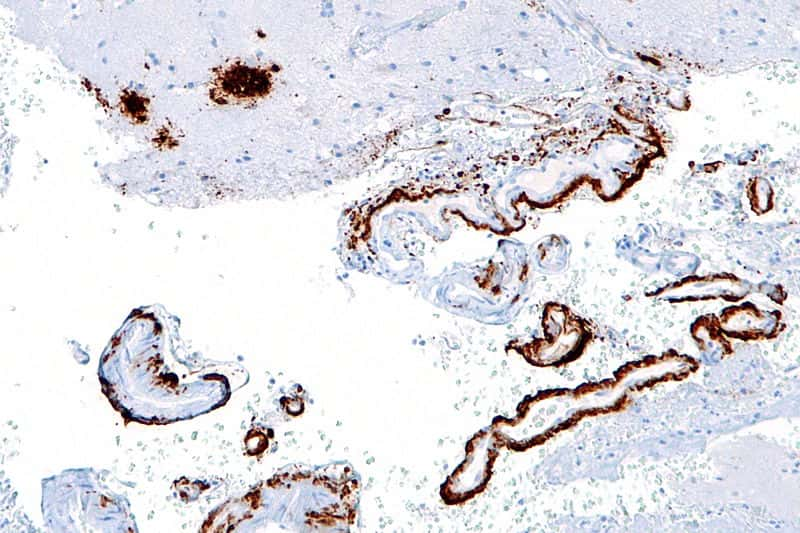
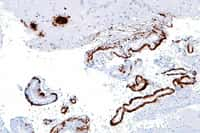
Cette image au microscope montre les plaques séniles (en marron) qui se forment entre les neurones du cortex cérébral. En elles-mêmes, elles pourraient ne pas être nocives, mais les bêta-amyloïdes qui les composent auraient auparavant contribué à détruire les synapses entre les neurones. © Nephron, Wikipédia, cc by sa 3.0
Dans cette nouvelle étude, les auteurs ont créé une souche de souris porteuses de deux gènesgènes humains prédisposant à la neurodégénérescence, chez qui, en plus, le gène à l'origine de PirB était éteint. Ces rongeursrongeurs présentent bien des dépôts de plaques séniles à l'âge adulte, mais semble-t-il aucun trouble cognitif. Les résultats aux tests de mémoire sont équivalents à ceux obtenus par les souris témoins. D'autre part, la flexibilité des synapses est préservée.
Les auteurs ont montré que les bêta-amyloïdes sont toxiques avant qu'ils s'agglomèrent en formant des plaques. Au départ, ils se retrouvent sous forme libre, puis s'agrègent en petits groupes, appelés oligomèresoligomères. À ce stade, ils restent solubles et se promènent librement dans le cerveau. En outre, ils présentent une très forte affinité pour PirB. En se liantliant à la protéine de surface, ils déclenchent une cascade d'événements, ce qui aboutit à l'affaiblissement puis au dépérissement des connexions synaptiques.
Vers un futur traitement de la maladie d’Alzheimer ?
Si l'on veut entrer un peu plus dans le détail, la liaison entre les bêta-amyloïdes et le récepteur neuronal favorise l'activité d'une enzymeenzyme : la cofiline. Retrouvée en quantités élevées chez les patients atteints d'Alzheimer, elle découpe l'actineactine, moléculemolécule essentielle au maintien des synapses. Les connexions disparaissent alors, et le message nerveux ne passe plus. Les troubles cognitifs commencent à se manifester. Les plaques séniles pourraient donc ne pas être impliquées.
L'Homme, en revanche, ne synthétise pas la protéine PirB. Mais il existe un équivalent : LilrB2. Les auteurs ont réalisé la même expérience sur du tissu cérébral humain ne produisant pas cette protéine, et les synapses ont tenu bon.
Cette découverte apporte donc des éléments expliquant pourquoi les traitements contre la maladie d’Alzheimer visant à éliminer les plaques séniles ne fonctionnent pas : les dégâts sont causés en amont. Mais elle laisse entrevoir l'émergenceémergence de nouveaux composés ciblant les interactions entre les bêta-amyloïdes et LilrB2. Cependant, cela suffira-t-il à soigner cette démence ? Difficile à croire, tant les causes semblent multiples. Mais c'est par un ensemble de petites victoires que les chercheurs feront peu à peu régresser la maladie d'Alzheimer.