au sommaire
La maladie d’Alzheimer touche environ 900.000 personnes en France. Dans le cerveau, la pathologie se manifeste par la présence de plaques amyloïdes, formées par l'accumulation de peptides bêtabêta-amyloïdes. Ces peptides proviennent d'une protéine précurseur appelée APP (Amyloid Protein Precursor) qui est coupée en petits fragments. En général, on considère que la mort des neuronesneurones est liée à la présence des plaques amyloïdes mais aussi à la protéine Tauprotéine Tau phosphorylée, responsable de dégénérescences neurofibrillaires.
Pour mieux comprendre le rôle des plaques amyloïdes, les chercheurs de l'université du Queensland (Australie) ont utilisé des cellules souchescellules souches provenant de patients ayant la trisomietrisomie 21. Ces personnes développent souvent des signes précoces d'Alzheimer. Comme le gènegène APP se trouve sur le chromosomechromosome 21, les personnes atteintes du syndrome de Downsyndrome de Down ont une copie supplémentaire de ce gène, ce qui pourrait expliquer ces symptômessymptômes précoces d'Alzheimer.
Les plaques amyloïdes ne sont pas seules responsables
Les chercheurs ont obtenu des neurones à partir des cellules souches et ils ont utilisé l'édition génomiqueédition génomique avec CRISPRCRISPR pour contrôler le niveau de production de la protéine dans les neurones. Ils ont observé que plus la protéine APP était produite, plus il y avait d'amas bêta-amyloïdes. Mais cette augmentation ne provoquait ni plus de mort neuronale, ni plus de protéines Tau toxiques (phosphorylées). Par conséquent, les plaques amyloïdes ne doivent pas être les seules responsables de la neurodégénérescence dans la maladie d'Alzheimermaladie d'Alzheimer.
Cette nouvelle recherche paraît dans Stem Cell Research.
Alzheimer : une nouvelle découverte sur ses causes possibles
Article de Janlou ChaputJanlou Chaput paru le 24 octobre 2012
On accuse depuis longtemps les bêta-amyloïdes et les plaques séniles qu'ils forment d'être à l'origine de la maladie d'Alzheimer. Mais si tout était plus complexe ? C'est ce que suggère une nouvelle étude tendant à montrer qu'il faudrait plutôt s'intéresser au lien entre les formes libres et les formes agrégées pour comprendre la maladie.
- Un dossier pour tout savoir de la maladie d'Alzheimer

C'est à s'en retourner les méningesméninges. Plus la recherche tente de décrypter la maladie d'Alzheimer, plus elle soulève de questions sans pour autant disposer de réponses. On accuse par exemple la protéine Tau ou des prions d'être à l'origine de cette démencedémence. Le suspect numéro 1 (mais il n'est probablement pas seul) reste une autre protéine, appelée bêta-amyloïde, qui s'agglomère et forme des plaques visibles chez tous les patients atteints par la maladie.
Mais les choses sont plus complexes. En effet, des sujets âgés disposant de toute leur tête présentent également ces agrégats protéiques à la surface de leurs neurones. En d'autres termes, la maladie d’Alzheimer se caractérise systématiquement par la présence de plaques amyloïdes mais les plaques amyloïdes seules ne suffisent pas à engendrer la démence. Quel rôle joue donc ce peptide ?
David Brody et son équipe de la Washington University School of Medicine, basée à Saint-Louis (États-Unis) suggèrent une nouvelle explication dans la revue Annals of Neurology. La différence entre patients et sujets sains résiderait plutôt au niveau des concentrations en bêta-amyloïdes présents dans leur forme libre au sein des neurones. Enfin, c'est encore plus précis que cela...
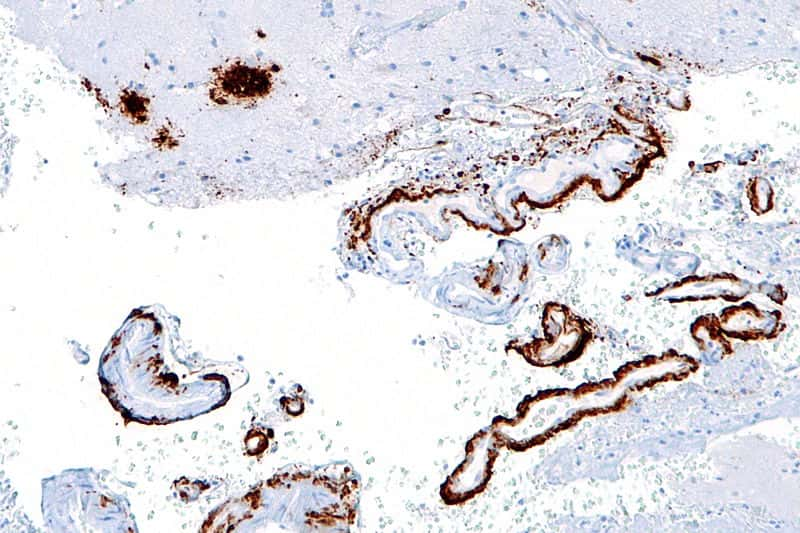
Cette image laisse apparaître les plaques amyloïdes (en brun) dans les neurones, marquées par immunocoloration. Celles-ci sont toujours retrouvées chez des malades d'Alzheimer, et chez certaines personnes exemptes de toute démence. © Nephron, Wikipédia, cc by sa 3.0
Des oligomères de bêta-amyloïdes dosés avec précision
Prenons les choses dans l'ordre. Les auteurs ont d'abord examiné le cerveau de 33 individus décédés entre 74 ans et 107 ans. Pour 10 d'entre eux, il n'y avait ni plaque, ni démence. Quatorze autres sujets n'étaient pas atteints par la maladie mais présentaient tout de même des plaques amyloïdes. Enfin, les 9 patients restants avaient déclaré Alzheimer et, de ce fait, n'échappaient pas à la formation des plaques.
Les scientifiques se sont intéressés aux deux derniers groupes. Pour aller plus loin dans l'investigation, ils ont décidé de doser la quantité de bêta-amyloïdes présents sous forme libre, appelés oligomèresoligomères, qui consistent en un assemblage de plusieurs de ces protéines, aboutissant à une structure trop petite pour former des plaques. Ces oligomères sont en ligne de mire depuis longtemps, mais les techniques classiques pour évaluer leur quantité restaient imprécises. Il était possible de caractériser leur présence ou leur absence et d'estimer leurs concentrations seulement s'ils étaient retrouvés en grandes quantités.
Les auteurs ont donc développé une nouvelle méthode de dosagedosage immunologique, basée sur un anticorpsanticorps fluorescent, pour détecter les bêta-amyloïdes à des concentrations de l'ordre du pg/ml. Ainsi, sujets sains présentant des plaques et malades d'Alzheimer ont pu être comparés de plus près.
La maladie d’Alzheimer, une histoire de ratio ?
Dans les deux cas, les plaques sont de même importance. En revanche, en moyenne, les individus sans démence présentaient des taux en oligomères inférieurs à ceux des personnes atteintes. Mais une moyenne ne rend pas toujours compte des différences individuelles. Or, certains sujets non malades avaient des concentrations similaires à leurs homologues affectés par la neurodégénérescence. Ce critère n'est donc pas suffisamment discriminant.
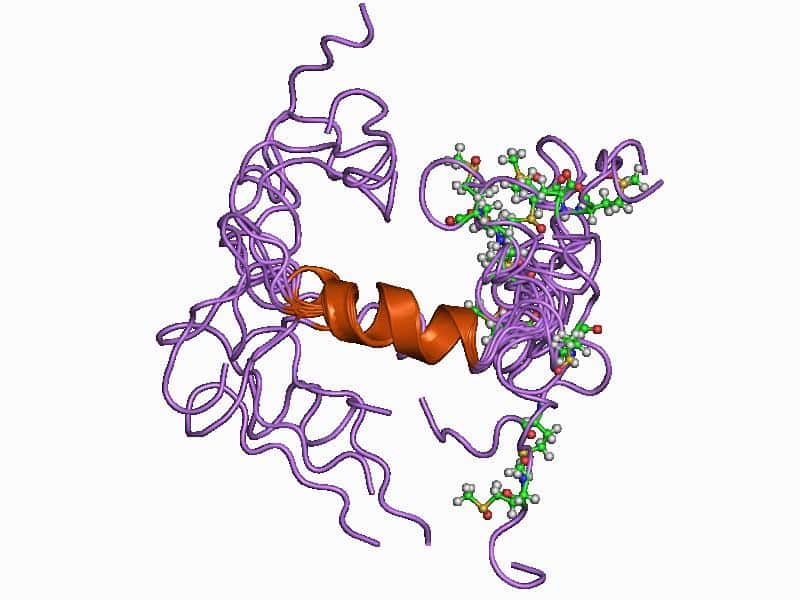
La protéine bêta-amyloïde (représentée sur cette image) se compose de 36 à 43 acides aminés. Elle se retrouve principalement dans le cerveau dans lequel elle s'associe avec d'autres bêta-amyloïdes pour former des oligomères. S'ils poursuivent leur agglomération, alors ils forment des plaques denses. © Jawahar Swaminathan, Wikipédia, DP
Pourtant, David Brody et son équipe ont finalement trouvé un paramètre qui différait entre les deux conditions : le ratio oligomères/plaques amyloïdes. Celui-ci se montrait systématiquement plus élevé chez les malades d’Alzheimer.
Les plaques amyloïdes discriminées ?
Qu'est-ce que cela signifie ? L'heure est aux conjectures. Les chercheurs émettent l'hypothèse que les plaques en elles-mêmes ne présentent aucune agressivité mais qu'elles pourraient jouer un rôle de tampon. Elles capteraient les bêta-amyloïdes libres de la cellule pour limiter dans le neurone la concentration en oligomères au pouvoir destructeur.
Cependant, chez les patients atteints d'Alzheimer, les plaques finiraient par saturer, ne pouvant plus prendre dans leur piège les petits assemblages de bêta-amyloïdes. Les voilà libres de tuer les neurones.
Mais de l'aveu même de David Brody, de nombreux points manquent de clarté. Il reconnaît par exemple que ce genre de dosage ne peut être réalisé que chez des personnes décédées. Or, rien n'atteste que ces oligomères se sont formés avant la mort de l'individu, ce qui pourrait rendre leur théorie brinquebalante.
« Comme la plupart des recherches sur la maladie d'Alzheimer, cette étude pose plus de questions qu'elle n'apporte de réponses, explique le chercheur américain. Mais c'est une nouvelle pièce importante du puzzle. » Reste à savoir maintenant combien de pièces manquent encore pour le compléter.