au sommaire
- Un dossier pour tout savoir sur la maladie d'Alzheimer
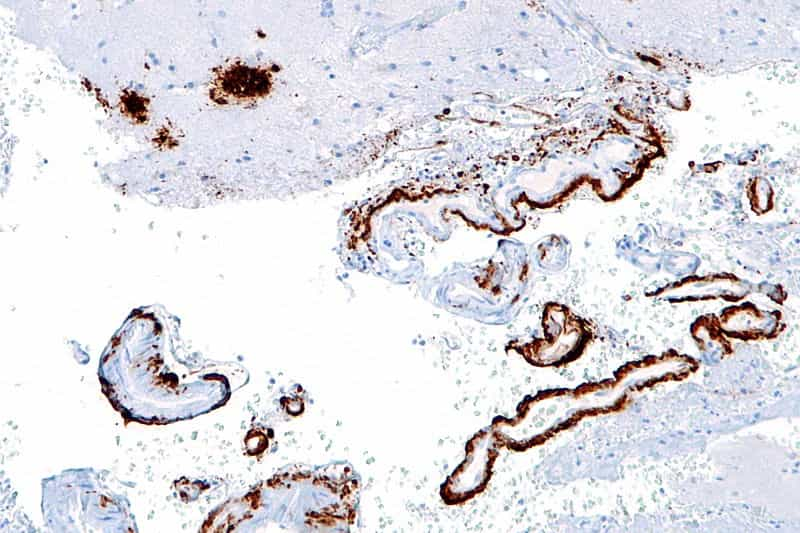
A-t-on levé un coin du voile sur le grand mystère AlzheimerAlzheimer ? La maladie neurodégénérative la plus fréquente s'accompagne toujours de plaques extracellulaires d'une protéine appelée bêta-amyloïdebêta-amyloïde et d'un enchevêtrement d'une seconde, appelée Tau. Si le caractère anormal de l'accumulation de ces moléculesmolécules avait frappé les neurologues, étaient-elles la cause ou une conséquence de la mort des neurones ?
La plupart des études les rangeaient plutôt dans le camp des coupables, même si aucune ne pouvait expliquer la neurodégénérescence. Une nouvelle recherche, annoncée lors du congrès annuel de l'American Society for Cell Biology, à San Francisco, tend à confirmer cette intuition : bêta-amyloïde et Tau inciteraient les cellules nerveuses à enfreindre la règle numéro 1 pour rester en bonne santé, celle qui proclame qu'il faut rester en dehors du cycle cellulaire. Les neurones entameraient alors un nouveau cycle de division qui n'aboutirait pas mais entraînerait leur mort.
Alzheimer : un problème de cycle cellulaire ?
En temps normal, la plupart des neurones se trouvent dans un état postmitotique, que l'on appelle G0. Dans cette phase, les cellules ne montrent aucun signe de division imminente ou à plus longue échéance : elles sont en latencelatence.
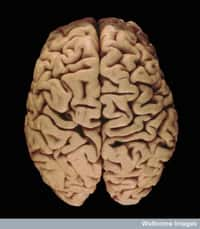
Le cerveau humain est probablement l'organe le plus secret. De ce fait, il rend la compréhension de certaines maladies qui l'affectent, comme la maladie d’Alzheimer, plus difficile ! © Heidi Cartwright, Wellcome Images, Flickr, cc by nc nd 2.0
Cependant, des scientifiques de l'université de Virginie (Charlottesville, États-Unis) ont remarqué que la bêta-amyloïdes pouvaient changer la donne. Ils ont exposé des neurones de souris à la protéine. Après 24 heures, l'ADN des neurones avait commencé à se dupliquer, étape caractéristique du cycle cellulaire. Sauf si la cellule nerveuse était dépourvue de protéine Tau, auquel cas elle restait en G0. Les deux molécules auraient donc un lien direct entre elles...
Et il a été déterminé. La bêta-amyloïde activerait des enzymesenzymes appelées protéines kinases, dont la fonction est d'ajouter des groupements phosphatephosphate à des composés. Trois d'entre elles (nommées Fyn, CaMKII et PKA) sont nécessaires pour que le neurone entame sa division, car chacune modifie la protéine Tau en un endroit spécifique. Les bêta-amyloïdes déclencheraient donc indirectement la prolifération de Tau.
Bêta-amyloïde et Tau, les coupables parfaits
L'étape suivante consistait à vérifier l'hypothèse in vivoin vivo. Toujours chez la souris, mais les rongeursrongeurs avaient été modifiés génétiquement pour présenter une mutation qui favorise l'accumulation des bêta-amyloïdes, conférant aux souris des troubles de la mémoire et de l'apprentissage très semblables à ceux que l'on retrouve chez les patients atteints d'Alzheimer. En parallèle, cette lignée a été croisée avec d'autres souris déficientes en protéine Tau.
Six mois plus tard, les cerveaux étaient disséqués. Avec la conjonctionconjonction des deux molécules, les scientifiques ont relevé la présence de protéines caractéristiques du cycle cellulaire, nouvelle preuve que les neurones avaient commencé une division qui n'a jamais abouti. En revanche, comme ils s'y attendaient, les animaux ne produisant pas la protéine Tau ne présentaient pas de signes de division cellulaire.
Les scientifiques imaginent déjà cibler les kinases ou les protéines Tau phosphorylées pour lutter contre la maladie. En bloquant l'entrée dans le cycle cellulaire, ils espèrent pouvoir préserver les neurones de leur déclin. Cela fonctionnera-t-il ?