On le sait, un taux élevé de cholestérol a des effets négatifs sur l’organisme en favorisant les maladies cardio-vasculaires. Une nouvelle étude américaine vient d’être publiée montrant un risque accru de développement de métastases dans les cancers du sein associés à une hypercholestérolémie. À l’heure où l’immunothérapie laisse entrevoir de nouveaux moyens de traiter les cancers, ce travail offre de nouvelles perspectives thérapeutiques.
au sommaire
Les cancers du sein représentent la première cause de décès par cancer chez la femme en France. Selon Santé publique France, près de 11 % de ces cancers post-ménopausiques seraient attribuables au surpoids et à l'obésité. De plus, 20 à 30 % des patientes présentant ce type de cancer développeront des métastases même si ce phénomène entraîne la mort de la plupart des cellules cancéreuses.
Une voie de mort cellulaire alternative : la ferroptose
Quand on parle de mort physiologique programmée des cellules de l'organisme, le premier terme qui vient à l'esprit est celui d'apoptose. Mais il existe d'autres mécanismes alternatifs et depuis 2012, une autre forme de mort cellulaire a été mise en évidence, la ferroptose. Ce processus de mort cellulaire par nécrose implique le ferfer libre dans l'organisme et l'occurrence d'une peroxydation lipidique massive (stress oxydatif)). Il en résulte une altération du métabolisme d'oxydoréductionoxydoréduction de la cellule et de la perméabilité membranaire conduisant à la mort de la cellule. Dans le cancer, la dissémination métastasique exige que les cellules augmentent leur absorption de lipides exogènesexogènes, générant un stress oxydatifstress oxydatif et les exposant ainsi à la mort cellulaire par ferroptose.
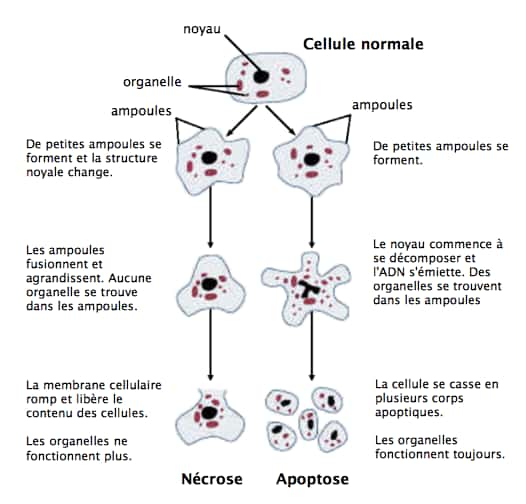
Une population de cellules cancéreuses protégées du stress oxydatif
Suite à l'observation selon laquelle l'hypercholestérolémiehypercholestérolémie est un facteur de risquefacteur de risque du cancer du seincancer du sein et entraîne de moins bons résultats chez les femmes ayant développé la maladie, les chercheurs de l'université de Duke aux États-Unis ont élaboré une étude, en cultivant in vitroin vitro des lignées de cellules cancéreuses (cancer du sein et mélanome). En les exposant au 27HC, un métabolitemétabolite circulant du cholestérol, ils ont mis en évidence la sélection d'une sous-population particulière. En effet, ces cellules spécifiques présenteraient une activité élevée de l'enzymeenzyme GPX4, impliquée dans la synthèse du glutathion protecteur naturel du stress oxydatif.
De plus, la présence d'un récepteur au 27HC augmenterait leurs capacités tumorigène et métastasique. Ce type de cellules, issues de la tumeurtumeur primaire pourraient ainsi se détacher de la matrice extracellulairematrice extracellulaire, se disséminer sans subir les mécanismes liés à la ferroptose.
Les implications thérapeutiques de ce travail sont multiples et divers axes sont à l'étude, soit en diminuant l'impact de l'hypercholestérolémie par un traitement adapté, soit en bloquant la conversion du cholestérolcholestérol en 27HC. De plus, la GPX4 en jouant un rôle central dans la résistancerésistance à la ferroptose pourrait de ce fait devenir un candidat pertinent pour le traitement des maladies cancéreuses, et plusieurs inhibiteurs de la GPX4 sont en cours de recherche.