au sommaire
La physique quantique nous a donné des clés fondamentales pour explorer l'univers, des particules élémentaires aux étoiles. Entre les deux se tient le monde de l'infiniment complexe qui se construit avec des atomes et des molécules dans des cellules vivantes. Pour les comprendre et créer de nouveaux médicaments, il faut notamment déterminer la structure des protéinesprotéines qui les composent. En effet, connaître leur formule chimique brute et même la position des fonctions chimiques sur ces énormes macromoléculesmacromolécules biologiques ne suffit pas. Il faut analyser leur structure tertiaire, c'est-à-dire les repliements de la chaîne polypeptidique des acides aminésacides aminés qui les composent. John Kendrew et Max Perutz y sont parvenus pour la première fois en 1957 en utilisant la cristallographie et la diffractiondiffraction des rayons Xrayons X, ce qui leur a permis de décrire la structure en trois dimensions de la myoglobinemyoglobine et de l'hémoglobinehémoglobine.
Cette méthode est encore employée aujourd'hui, mais elle impose de disposer de grandes quantités de macromolécules et surtout de les obtenir à l'état cristallin. Cela n'est pas toujours possible, ni facile, et le procédé interdit de les étudier individuellement et in vivoin vivo. Les alternatives connues sont la microscopie électronique et la résonance magnétique nucléairerésonance magnétique nucléaire.
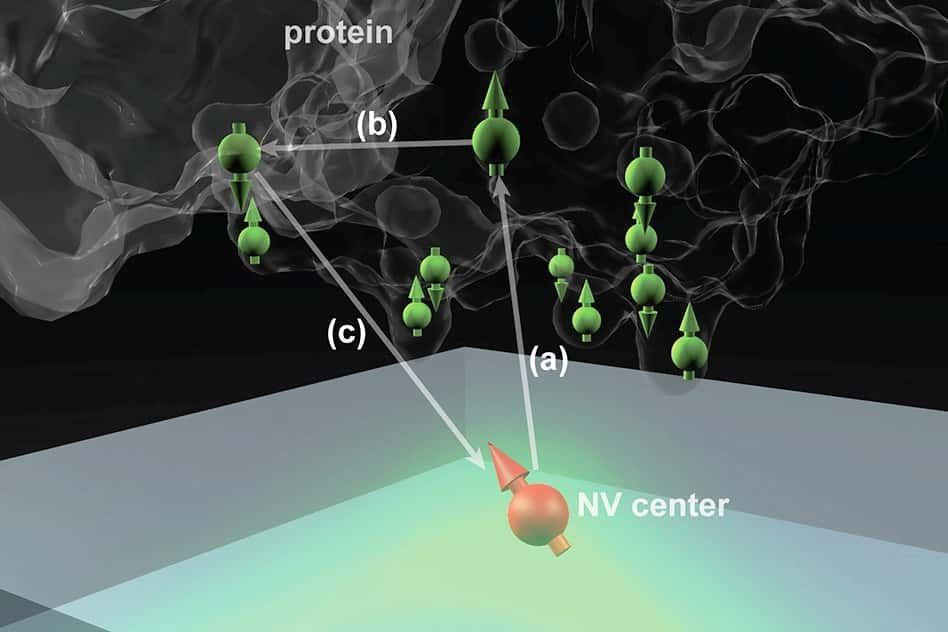
Le centre coloré NV d'un diamant peut être utilisé comme sonde quantique sensible aux états de spins (flèches vertes) et aux positions des atomes dans la protéine. La mesure de l'état de spin (flèche orange) du centre NV permet alors de déterminer ces positions. © MIT
Des diamants comme sondes quantiques pour la biologie
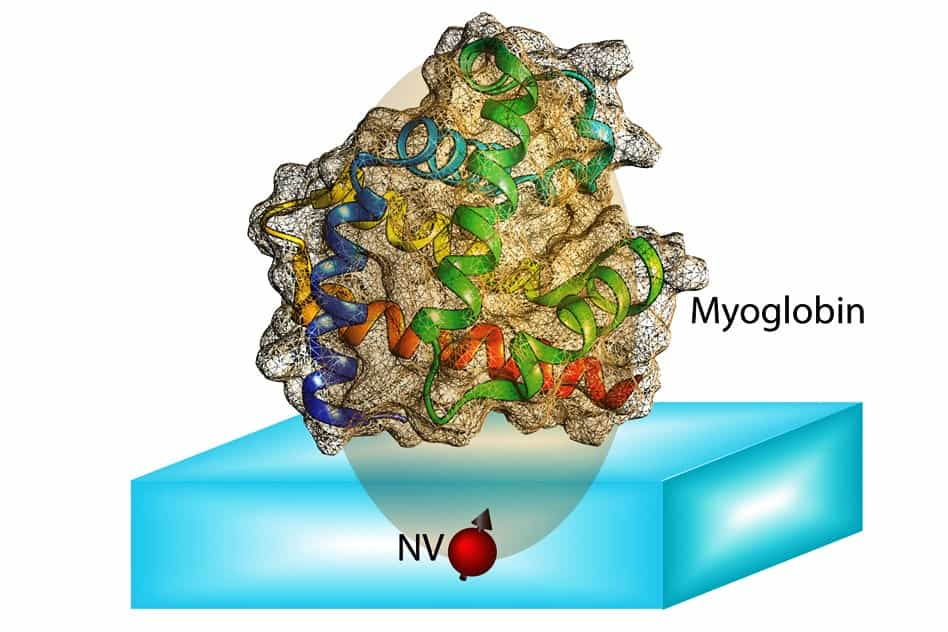
Dans un article déposé sur arxivarxiv, un groupe de chercheurs décrit, de façon purement théorique pour l'instant, une méthode prometteuse pour tout à la fois éliminer la contrainte de la cristallisation des protéines et déterminer la structure tertiaire à partir d'une seule molécule. Ils mobilisent pour cela des centres colorés NV dans les diamantsdiamants et leurs propriétés quantiques. Rappelons qu'il s'agit de défauts dans la structure cristalline des diamants formés de l'association d'un atome d'azoteazote et d'une lacune remplaçant deux atomes de carbonecarbone. Ces centres colorés au sein des diamants font actuellement l'objet de travaux, notamment pour leur possible exploitation dans les ordinateurs quantiquesordinateurs quantiques. On a également cherché à s'en servir comme des sortes de sondes quantiques pour étudier l'intérieur des cellules vivantes, y mesurer des températures et des champs magnétiques.
Dans le cas présent, les chercheurs du MIT, de la Singapore University of Technology and Design et de l'université de Harvard pensent que l'on peut mettre à profit des centres colorés situés à quelques nanomètresnanomètres sous la surface de diamants. L'état quantique de ces centres est influencé par ceux des spinsspins des protonsprotons et des électronsélectrons dans une protéine déposée sur cette surface. Selon les physiciensphysiciens, cet état modifie les caractéristiques de la lumière qu'il émet par fluorescence sous l'action d'un faisceau laserlaser. En mesurant ces caractéristiques, on peut ensuite reconstruire indirectement la répartition dans l'espace des atomes constituant la protéine étudiée, du moins, répétons-le, en théorie.
Les chercheurs sont tout de même confiants, même s'ils pensent qu'il faudra encore quelques années pour passer de la théorie à la pratique. Ils espèrent, sans en être certains, qu'il serait même possible de ne pas avoir recours à des températures très basses et des vides poussés pour conduire leurs expériences. Ce serait un avantage supplémentaire par rapport aux autres techniques de détermination de la structure tertiaire des protéines utilisées jusqu'à présent.