Les interactions entre les protéines S virales de surface et leur récepteur cellulaire sont un élément clé pour que le coronavirus puisse entrer dans la cellule. Une étude américaine a identifié une zone de la protéine S qui, si elle est modifiée, réduit la force de ces interactions.
au sommaire
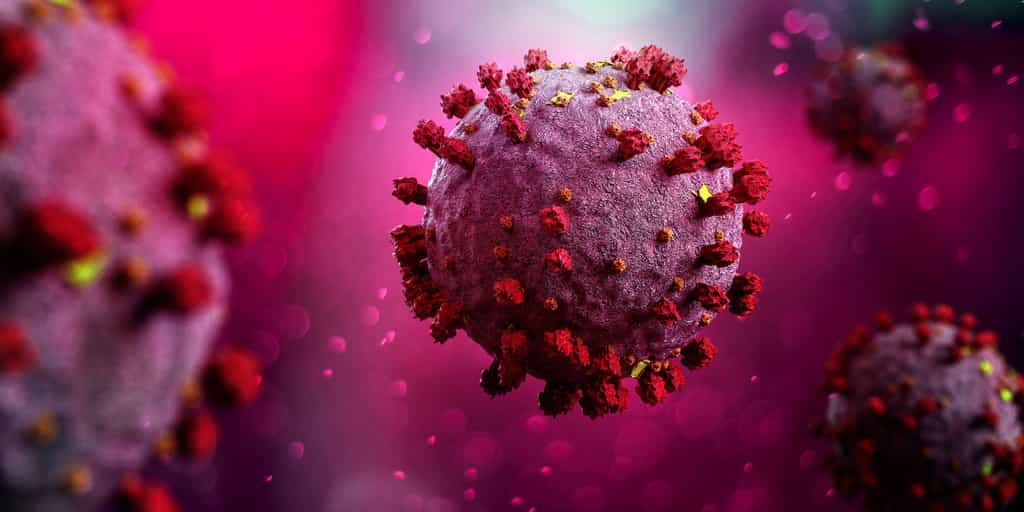
Depuis son émergenceémergence, le coronavirus SARS-CoV-2 est étudié sous toutes les coutures par des scientifiques du monde entier. Parmi les structures de ce virus, la protéine S est sûrement l'une des plus étudiées. En effet, c'est cette protéine qui se lie au récepteur cellulaire ACE2 et qui autorise l'entrée du virus dans la cellule hôte. Une région bien précise de la protéine S est l'objet de recherches, la région RBD pour receptor binding site, qui correspond au petit bout de la protéine S qui est physiquement en contact avec ACE2.
Pourtant, deux chercheurs de l’université Evanston de l’Illinois ont identifié une autre région de la protéine S, située à quelques nanomètresnanomètres du domaine RBD qui, si elle est modifiée, affaiblit la liaison RBD-ACE2, ce qui aurait un effet sur la capacité du virus à entrer dans la cellule.
Action à distance
À 10 nanomètres du site RBD et entre les deux sous-unités de la protéine S, se trouve un site de coupure polybasique, composé de trois argininesarginines et une alaninealanine qui confère à ce site une charge globale positive, pour une enzymeenzyme appelée la furine. Cette coupure est indispensable pour activer la fusionfusion de l'enveloppe virale avec la membrane cellulairemembrane cellulaire.
Les chercheurs ont donc comparé l'affinité du site RBD avec ACE2 d'une protéine S native, et de deux mutants pour lesquels ils ont modifié le site de coupure polybasique. Pour le premier mutant, les scientifiques ont enlevé des acides aminésacides aminés du site polybasique et pour le second, ils en ont remplacé deux.
Pour le premier mutant, les interactions RBD-ACE2 diminuent de 36 % et pour le second mutant, de 20 %. Par conséquent, la modification d'un site de la protéine S qui n'est pas celui de liaison au récepteur cellulaire influe aussi sur la capacité du virus à infecter sa cellule hôte.
Une cible thérapeutique ?
Au vu de ses résultats encourageants, les scientifiques ont envisagé ce site polybasique comme cible thérapeutique. Ils ont donc synthétisé un petit peptide composé de quatre acides aminés chargés négativement pour le neutraliser. La présence du tétrapeptide fragilise la liaison RBD-ACE2 en diminuant le nombre de liaison hydrogèneliaison hydrogène de 41 %.
Cette étude n'a pas testé la capacité d'entrée du virus SARS-CoV-2 entier en présence du tétrapeptide ou des deux mutants dans des cellules in vitroin vitro. Les interactions fragilisées entre le RBD et ACE2 n'ont pour le moment qu'un effet supposé sur l'infectiosité du virus dans les conditions réelles de l'infection.