au sommaire
La neuraminidase existe sous neuf formes différentes, et ce sont les structures de N2 et N9 qui ont servi à élaborer le Tamiflu et le Relenza. Or, des chercheurs du National Institute of Medical Research (Londres) viennent d'annoncer que le site actif de la forme N1 - celle du virus H5N1virus H5N1 - possède une cavité que N2 et N9 ne présentent pas. Cette découverte, relayée par le site d'informations de la revue Nature, devrait permettre la mise au point d'inhibiteurs plus efficaces.

Des chercheurs ont mis en évidence la présence d'une cavité insoupçonnée sur le site actif de la protéine N1
Cette découverte pourrait aboutir à la conception de médicaments plus efficaces
(Crédits : www.creapharma.ch)
Le virus H5N1 est la forme la plus virulente de la grippe aviaire, celle qui fait craindre aux experts une pandémie. Les lettres H et N rappellent que son enveloppe contient deux protéines, l'hémagglutininehémagglutinine et la neuraminidase. La première existe sous seize formes et permet au virus de se lier aux cellules, la seconde compte neuf variantes connues et sert à le propager. Pour des raisons pratiques, les différents types de virus de la grippevirus de la grippe tirent leur nom des diverses versions d'hémagglutinine et de neuraminidase qu'ils présentent.
A l'heure actuelle, les médicaments oseltamiviroseltamivir (plus connu sous le nom de Tamiflu) et zanamivirzanamivir (communément appelé Relenza) sont les meilleurs moyens de combattre le virus H5N1 de la grippe aviaire. Leur rôle est d'inhiber la neuraminidase, et ainsi d'endiguer la prolifération. A l'époque où ils ont été conçus, seules les formes N2 et N9 de la neuraminidase avaient été étudiées par cristallographiecristallographie aux rayons Xrayons X, et c'est donc tout naturellement qu'on avait octroyé aux médicaments la structure moléculaire adéquate. Les scientifiques avaient ensuite pu vérifier l'efficacité du Tamiflu et du Relenza sur les autres types de neuraminidases, et en avaient conclu que la géométrie du site actif de la protéine ne différait pas d'une forme à l'autre.
Or, selon John Skehel et ses collègues du National Institute for Medical Research, cette extrapolation est en partie erronée. Par cristallographie aux rayons X, ils ont étudié les structures de trois autre types de neuraminidases, N1, N4 et N8, et ont constaté qu'elles différaient des variantes N2 et N9 par la présence d'une petite cavité d'un nanomètrenanomètre de long sur 0,5 nanomètre de hauteur et 0,5 de large.
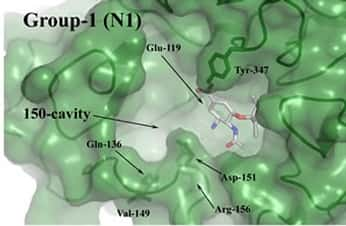
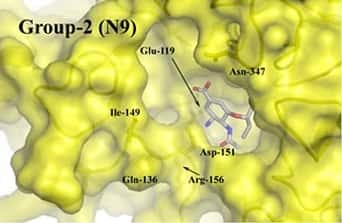
Le site actif de la forme N1 de la neuraminidase présente une cavité que ne comporte pas d'autres variantes
(Courtesy of Skehel et al)
C'est donc en partie par chance que le Tamiflu et le Relenza se révélaient capables d'inhiber la forme N1 de la neuraminidase. Maintenant que cette information est connue, Skehel suggère de mettre au point de nouveaux médicaments spécifiques, dont les structures s'emboîteraient parfaitement dans les sites actifs du virus H5N1.
De nouveaux inhibiteurs de la neuraminidase sont d'ores et déjà à l'étude, notamment une version de zanamivir administrable par voie intraveineuse. Pour l'heure, il doit être inhalé, ce qui réduit son efficacité dès lors que les poumonspoumons sont touchés. En tous cas, la découverte de cette cavité dans la variante N1 devrait faire avancer de manière significative les scientifiques dans leur lutte contre la grippe aviaire.