Le CO2 atmosphérique est en grande partie responsable du réchauffement climatique que nous vivons actuellement. Des chercheurs proposent aujourd’hui de recycler ce CO2 en acide formique dans un réacteur alimenté par de l’électricité renouvelable. Un acide formique qui pourrait, entre autres, alimenter les piles à combustible de nos futures voitures à hydrogène.
au sommaire
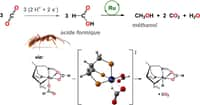
Tout le monde sait désormais que le dioxyde de carbone, le fameux CO2, est un gaz à effet de serre. Pour limiter le réchauffement climatique anthropique en cours, de nombreux scientifiques cherchent des solutions afin d'en réduire les émissionsémissions. Mais d'autres espèrent parvenir à transformer ce CO2 en des produits utiles. C'est le cas de chercheurs de l'université Rice (États-Unis). Ils annoncent avoir mis au point un réacteur catalytique qui utilise le dioxyde de carbone comme matièrematière première et qui produit de l'acideacide formique - ou acide méthanoïque, de formule CH2O2 - purifié et à forte concentration.
Le saviez-vous ?
D’autres travaux ont montré qu’il est possible, à l’aide d’un catalyseur, de décomposer l’acide formique (CH2O2) en hydrogène (H2) et en dioxyde de carbone (CO2). Ainsi l’acide formique peut être présenté comme une solution de stockage de l’hydrogène.
« L'acide formique est un vecteur d'énergieénergie. Un carburant à pile à combustiblepile à combustible capable de générer de l'électricité. En émettant du CO2, certes, mais un CO2 que l'on peut désormais envisager de récupérer et de recycler », précise Haotian Wang, ingénieur en génie chimique et biomoléculaire. « Plus largement, en tant que matériaumatériau de stockage de l’énergie, l'acide formique peut contenir près de 1.000 fois l'énergie d'un volumevolume équivalent d'hydrogènehydrogène sous forme de gazgaz. »
Pour s'assurer une empreinte carbone minimale, le réacteur mis au point à l'université Rice doit bien sûr fonctionner à partir d'électricité renouvelable. Son rendement de conversion d'énergie est aujourd'hui d'environ 42 %. Presque la moitié de l'énergie électrique peut donc ainsi être stockée dans de l'acide formique sous la forme d'un carburant liquideliquide.
Un électrolyte solide
Pour faire fonctionner leur système, les chercheurs ont dû développer deux innovations. D'abord, un catalyseurcatalyseur au bismuthbismuth, robuste et bidimensionnel. Un nanomatériau produit au kilogrammekilogramme afin de faciliter le transfert du procédé vers l'industrie. Puis, un électrolyte solidesolide à base de polymèrepolymère recouvert de groupes fonctionnels lui permettant de conduire tant des charges positives que des charges négatives. De quoi permettre aux chercheurs de s'affranchir des classiques électrolytes liquides. Ceux-ci en effet contiennent nécessairement des sels qui se mélangent à l'acide formique produit, et qui contraignent de fait à de lourdes opérations de purification.
Avec leur réacteur actuel, les ingénieurs de l'université Rice ont généré de l'acide formique pendant 100 heures avec une dégradation négligeable des composants. Sachant que la vitessevitesse à laquelle l'eau traverse le système détermine la concentration de la solution obtenue, un débitdébit lent, par exemple, produit une solution contenant près de 30 % en poids d'acide formique.
Les chercheurs espèrent déjà obtenir des concentrations plus élevées grâce à une nouvelle génération de réacteur qui permettra d'introduire un flux de gaz et de produire des vapeurs d'acide formique. Et pourquoi pas, d'autres produits de valeur comme de l'acide acétique, de l'éthanol ou du propanol.
Et si le CO2 devenait une source d'énergie ?
Une équipe de chercheurs vient de développer un procédé capable de transformer le dioxyde de carbone (CO2) en méthane (CH4) à l'aide de lumièrelumière solaire et d'un catalyseur moléculaire à base de ferfer. Ces résultats ouvrent une nouvelle voie vers la production de « carburant solaire » et le recyclage du CO2.
Article du CNRS paru le 18/07/2017

Le dioxyde de carbone (CO2) est aujourd'hui considéré comme un déchet. Son recyclage, en l'utilisant en tant que matière première, est un défi majeur pour la recherche scientifique et un enjeu politique de premier plan. Marc Robert et Julien Bonin ont mis au point un procédé capable de le convertir en méthane, principal composant du gaz naturel qui est la troisième source d'énergie la plus utilisée au monde après le pétrolepétrole et le charbon.
Au cours de ce processus, la moléculemolécule de CO2 perd progressivement ses atomesatomes d'oxygène qui sont remplacés par des atomes d'hydrogène, stockant au passage de l'énergie sous forme de liaisons chimiquesliaisons chimiques. Cette transformation, dite « réaction de réduction », permet d'obtenir une variété de composés allant du monoxyde de carbonemonoxyde de carbone et de l'acide formique (des matières premières clés pour l'industrie chimique) au méthanol (un carburant liquide), jusqu'au méthane, forme la plus réduite ayant concentré le plus d'énergie.
Un nouveau pas vers une transition énergétique
Si la plupart des processus connus utilisent des catalyseurs basés sur des métauxmétaux rares et précieux, les deux chercheurs ont développé un catalyseur à base de fer, un métal abondant, accessible et peu coûteux sur TerreTerre. Aucun autre catalyseur moléculaire n'avait permis à ce jour de réaliser la réduction complète du CO2 en CH4. Ce processus catalytique fonctionne à pressionpression et température ambiantes, en utilisant la lumière solaire comme seule source d'énergie, et ouvre la voie à une utilisation circulaire du CO2.
En démontrant que la combinaison de la lumière solaire et d'un catalyseur à base de fer est capable de transformer le CO2 en une molécule à fort contenu énergétique, le Laboratoire d'électrochimie moléculaire (université Paris-Diderot, CNRS) montre qu'il est possible de stocker l'énergie solaire renouvelable en une forme de carburant compatible avec les infrastructures industrielles et les réseaux d'énergie existants. Ces travaux ont été publiés dans la revue Nature le 17 juillet 2017.
Produire de l'énergie du CO2 à partir de bactéries
Article de Nathalie MayerNathalie Mayer publié le 24 février 2017
Pour limiter les effets sur le climatclimat du dioxyde de carbone (CO2), on peut travailler à réduire son émission dans l'atmosphèreatmosphère. On peut également chercher un usage à ce gaz à effet de serregaz à effet de serre réputé indésirable. Et pourquoi ne pas en tirer de l'énergie ? C'est l'idée de scientifiques britanniques qui veulent faire travailler des bactériesbactéries.
Les records de concentration en dioxyde de carbone (CO2) dans notre atmosphère ne cessent de tomber, à tel point que le point de non-retour semble atteint. Mais les scientifiques ne sont pas du genre à baisser les bras. En attendant que de vraies mesures de limitation des émissions de CO2 soient adoptées et respectées, ils réfléchissent à des solutions alternatives. Comme cette équipe de l'université du Kent (Royaume-Uni) qui cherche à comprendre comment convertir efficacement le CO2 en méthane utilisable pour produire de l’énergie.
Des organismes dits à métabolismemétabolisme méthanogène pourraient s'en charger. Des bactéries produisent en effet du méthane (CH4) à partir de CO2. Ces organismes seraient même responsables du tiers du méthane rejeté dans notre atmosphère. Mais leur culture -- et, de fait, l'industrialisation du procédé -- reste compliquée.

Mieux comprendre la biosynthèse du méthane
Ce qui permet à ces bactéries de produire aussi efficacement du méthane à partir de CO2, c'est le cofacteur F430, qui catalysecatalyse la réaction. Les chercheurs de l'université du Kent se sont donc naturellement demandé comment les bactéries en question parviennent à synthétiser ce cofacteur. Une question fondamentale dont les implications pourraient être grandes.
Ils sont finalement parvenus à identifier les protéinesprotéines qui elles-mêmes catalysent la synthèse du cofacteur F430. De quoi espérer concevoir des bactéries tout aussi efficaces dans la conversion de CO2 en méthane, mais bien plus « dociles » et intégrables dans un processus industriel.
Ce qu’il faut
retenir
- Des chercheurs proposent de recycler le CO2 en acide formique, un vecteur d’énergie intéressant.
- Et ce, grâce à un réacteur alimenté par des énergies renouvelables au cœur duquel on trouve notamment un électrolyte solide qui permet d’obtenir des produits purs.