au sommaire
La nature qui nous entoure : les atomes
Vers 450 avant J.-C., le philosophe grec Démocrite imagine que la matière est formée d'un assemblage de particules « insécables, impassibles et impérissables » : les atomes (du grec atomos : qui ne peut pas être coupé). Il faut pourtant attendre le tout début du XIXe siècle pour que la théorie atomique soit enfin scientifiquement formulée.

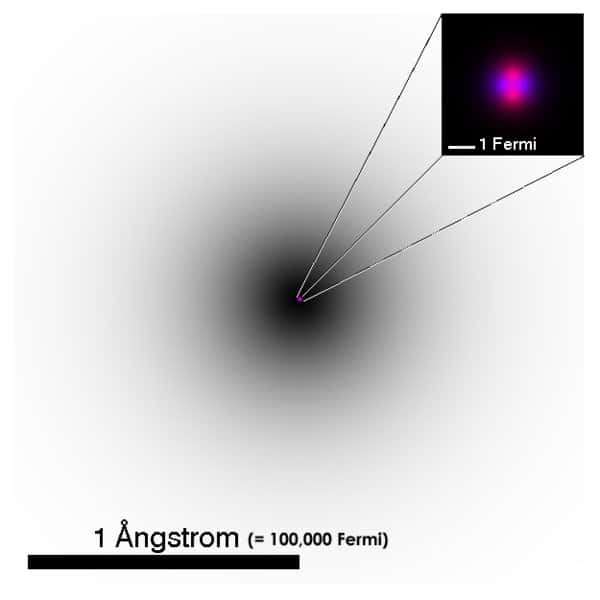
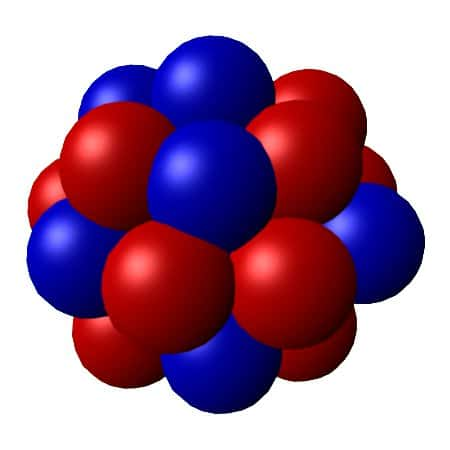
Représentation chimique d'un noyau atomique. © PerOx, Wkipédia, domaine public
C'est le physicienphysicien chimiste anglais John DaltonJohn Dalton qui, suite à des travaux sur l'absorptionabsorption des gaz par l'eau, émet le premier l'idée que chaque élément chimique est constitué d'atomes différents de ceux des autres éléments. Quelques années plus tard (1869), le chimiste russe Dmitri Ivanovitch Mendeleiev établit un tableau recensant les atomes connus selon leur masse.
Les caractéristiques de l'atome
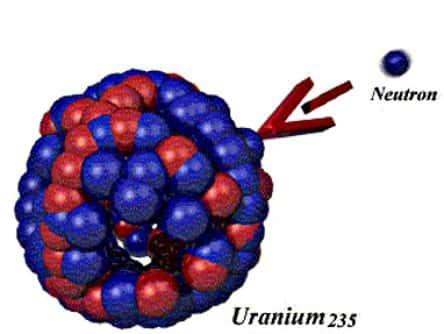
Mais, les atomes ne sont pas les parties ultimes de la matière. Ils sont eux-mêmes composés d'électronsélectrons, gravitant autour de noyaux. Les noyaux sont des sortes de sacs, remplis de billes de deux sortes : les protonsprotons et les neutronsneutrons. Électrons, protons et neutrons sont tous trois des particules minuscules, la première véhiculant de l'électricité négative, la deuxième de l'électricité positive et la troisième ne portant aucun électricité. Chaque atome contient autant d'électrons que de protons de manière à assurer sa neutralité électrique. Chacun contient également un nombre sensiblement égal de neutrons et de protons. Il existe des atomes simples comme celui de l'hydrogènehydrogène dont le noyau est constitué d'un seul proton et d'autres plus complexes. C'est le cas de l'uranium qui contient 92 protons et 143 ou 146 neutrons selon les cas. Un même élément peut en effet être représenté par des atomes dont le nombre de neutrons diffère. On appelle ces atomes des isotopesisotopes de l'élément. Les isotopes de l'hydrogène, par exemple, ont un proton et un électron et ont zéro, un ou deux neutrons. Ce sont l'hydrogène léger (appelé souvent hydrogène tout court car c'est le plus répandu), l'hydrogène lourd ou deutérium, et le tritiumtritium.
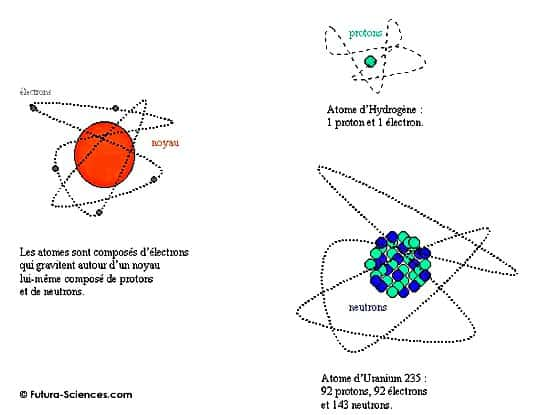
La structure de l'atome. © Futura-Sciences
Les noyaux d'atomes stables et instables
La plupart des noyaux d'atomes qui existent dans la nature sont en quelque sorte immortels. Ils existent depuis des milliards d'années et seront toujours là dans des milliards d'années. On dit qu'ils sont stables. D'autres noyaux dits instables se désintègrent au bout d'un certain temps d'existence.
D'où vient cette différence ? Des forces en action au cœur de la matière. Les protons chargés positivement ont tendance à se repousser sous l'effet d'une force dite électrique. Seulement, neutrons et protons eux, s'attirent sous l'action d'une force très intense : la force nucléaire. Aussi longtemps que les deux forces en jeu se compensent, les noyaux atomiques sont stables mais, si le noyau présente un déséquilibre trop important entre le nombre de protons et le nombre de neutrons, la force électrique finit par l'emporter et le noyau par se désintégrer.