au sommaire
S'il n'est pas traité à temps, un cancer du sein a de fortes chances de provoquer des métastases, c'est-à-dire de nouveaux foyers tumoraux dans d'autres endroits du corps. Cette diffusiondiffusion de la maladie s'explique par l'évasion de cellules de la tumeur initiale, qui s'échappent pour aller s'implanterimplanter ailleurs. Or la glande mammaire est entourée d'une membrane dite basale, c'est-à-dire une enveloppe constituée de différentes moléculesmolécules (du collagène notamment) mais dépourvue de cellules. Des membranes basalesmembranes basales isolent les tissus profonds des épithéliumsépithéliums (comme l'épidermeépiderme et la paroi intestinale ou de la vessievessie). Empêchant le passage des cellules ou des bactériesbactéries, elles filtrent également les transferts de molécules.
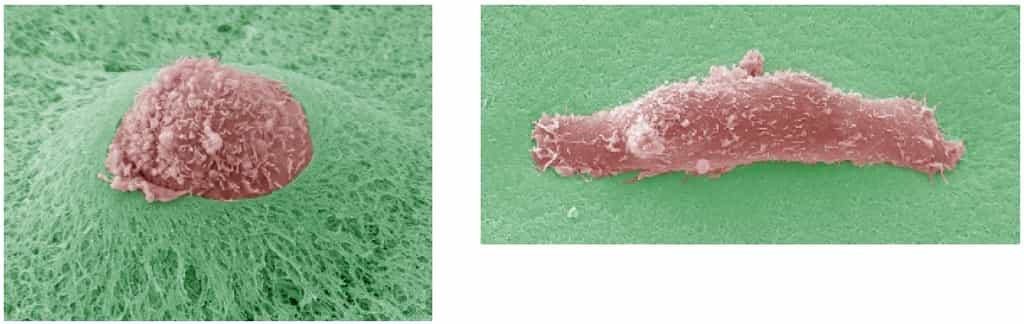
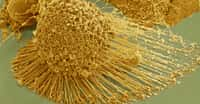
Pour s'échapper, les cellules d'une tumeur doivent donc la traverser, d'une manière ou d'une autre. C'est sur ce mystère qu'un nouvel éclairage vient d'être apporté par Philippe Chavrier et son équipe du laboratoire Dynamique du Cytosquelette et de la Membrane, de l'Institut Curie. Après avoir migré vers la membrane, les cellules tumorales produisent des excroissances, appelées invadopodesinvadopodes, qui s'appliquent contre la paroi à traverser et y amènent, depuis l'intérieur de la cellule, des molécules chargées de la perforer, en l'occurrence des protéasesprotéases, c'est-à-dire des enzymesenzymes dégradant les protéinesprotéines.
Pour y parvenir, les cellules tumorales doivent donc bouger et se déformer, comme le font les amibesamibes. Ces mouvementsmouvements cellulaires, communs mais longtemps restés incompris, font l'objet de recherches qui ont beaucoup progressé depuis une vingtaine d'années. Ils reposent sur une structure interne à la cellule, appelée cytosquelettecytosquelette. Ce dispositif complexe est formé d'un réseau de filaments souples d'actine (une protéine) et de microtubules, plus rigides. Ce réseau se réorganise en permanence, sous l'action de protéines de la famille Rho, justement la spécialité de Philippe Chavrier.
Une perceuse très au point
Grâce à ce cytosquelette, la cellule peut changer de forme mais aussi produire à sa surface un ballet d'invaginations et de protubérances transitoires, par exemple pour entourer puis gober des éléments extérieurs. La phagocytosephagocytose, attaque d'un microbemicrobe par une cellule spécialisée (un phagocyte), en est un exemple. Mais, plus généralement, cette activité au niveau de la membrane est responsable des interactions entre une cellule et son voisinage.
Une série de structures se forment ainsi sur la membrane cellulairemembrane cellulaire, regroupant des protéines spécifiques et jouant chacune un rôle particulier. Parmi elles, on observe des protubérances constituées d'un cœur d'actineactine, les invadopodes et les podosomespodosomes, différant subtilement par leur architecture interne.
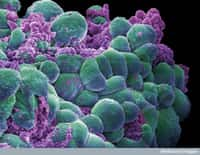
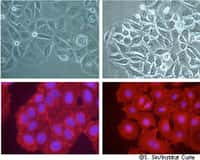
Ce sont des invadopodes que l'équipe de Philippe Chavrier a détectés en pleine action au niveau de la membrane basale, formés par des cellules cancéreuses mammaires mises en culture. L'équipe a pu reconstituer les événements se déroulant à l'intérieur de cette structure complexe.
Tout d'abord, les invadopodes transportent vers leur extrémité des vésicules provenant de l'intérieur de la cellule et contenant les protéases qui perceront la membrane basale. L'équipe a démontré le rôle de trois protéines, sec3, sec8 et IQGAP1, indispensables à ce transport.
Une fois ces vésicules parvenues à l'extrémité de l'invadopode, la membrane qui les entoure fusionne avec celle de la cellule et leur contenu est déversé à l'extérieur, donc au contact de la membrane basale. Alors les protéases pourront jouer leur rôle en grignotant l'enveloppe de la glande mammaire. La cellule tumorale n'aura plus qu'à se glisser dans l'orifice et s'enfuir.
L'équipe a décrit ces mécanismes dans deux publications, The Journal of Cell Biology et Current Biology, et les ont démontrés en parvenant à les bloquer. En inhibant l'activité des protéines sec3, sec8 et IQGAP1, ils empêchent les vésicules d'être transportées le long de l'invadopode et donc d'arriver à pied d'œuvre. En bloquant une autre protéine, VAMP-7, ils interdisent à la membrane des vésicules de fusionner avec celle de la cellule et donc aux protéases d'attaquer la membrane basale.
La compréhension de cette technique d'évasion permettra peut-être d'expliquer pourquoi certains cancers du sein ont davantage que d'autres tendance à provoquer des métastases. Il deviendrait alors envisageable de repérer des tumeurs dangereusement invasives et donc de les traiter différemment. Ce travail ouvre aussi, peut-être, de nouvelles voies thérapeutiques s'il s'avère possible de prévenir les évasions de cellules tumorales.