au sommaire
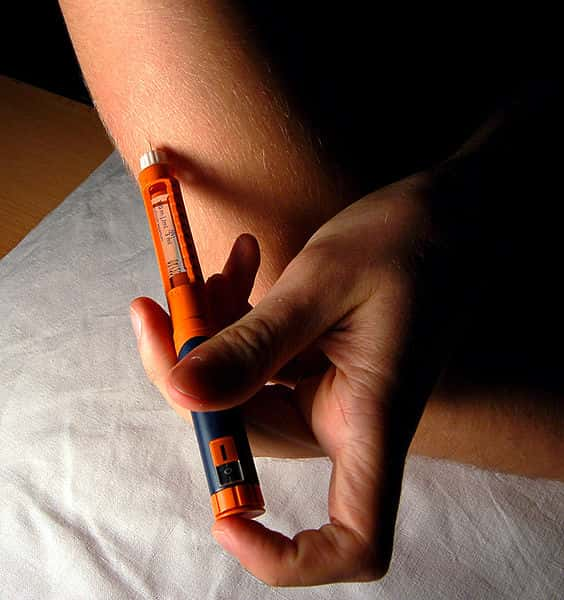
Les diabétiques insulino-dépendants sont contraints de s'injecter de l'insuline plusieurs fois par jour. © Mr Hyde / Wikimedia Commons
Le diabète touche environ 200 millions de personnes dans le monde. Une des formes du diabète, le type 1, ou insulino-dépendant, se caractérise par une hyperglycémie, conséquence de la destruction de l'insuline synthétisée par le pancréas. Cette maladie auto-immune a pour origine un dysfonctionnement du système immunitaire : les cellules immunitaires nommées lymphocytes TT reconnaissent l'insuline comme du « non-soi », pourtant synthétisée par l'organisme. Les causes de cette mauvaise reconnaissance sont encore en débat, mais une équipe de l'Université du Colorado Denver pense avoir résolu l'énigme.
Pendant le développement du système immunitaire, des cellules appelées lymphocytes T sont triées en fonction de ce qu'elles sont capables de reconnaître. Des moléculesmolécules du CMH II (complexe majeur d'histocompatibilitécomplexe majeur d'histocompatibilité )) sont utilisées pour présenter différents peptidespeptides (morceaux de protéinesprotéines) aux lymphocytes T. Si les lymphocytes reconnaissent ces peptides qui proviennent de l'organisme et qui sont donc du « soi », les lymphocytes en question sont automatiquement détruits. Ceux qui ne reconnaissent aucun peptide sont activés : ils pourront servir pour la lutte contre le « non-soi » qui regroupe l'ensemble des ennemis de l'organisme. Si le tri est mal fait, les cellules qui reconnaissent le soi ne sont pas détruites : c'est le cas des maladies auto-immunesmaladies auto-immunes comme le diabète de type 1.
Les souris NOD (non-obese diabetic) représentent un modèle d'étude du diabète insulino-dépendant. Elles ont pour particularité d'avoir un CMH II d'un type particulier (type IAIAg7) et de développer spontanément la maladie. Le lien entre le polymorphisme du CMH II et l'auto-immunitéimmunité est donc clair, mais son mécanisme est moins bien appréhendé. Une hypothèse est plus particulièrement soutenue : l'interaction entre le CMH II type IAg7 et le peptide de l'insuline serait plus forte que dans le cas des autres types de CMH II. L'article publié dans Proceedings of the National Academy of Sciences indique que ce serait plutôt le contraire.
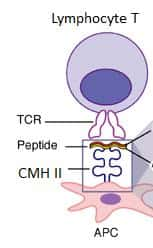
Le mécanisme de la présentation du peptide s'effectue entre la cellule présentatrice d'antigène (APC) via le CMH II, et le lymphocyte T via son récepteur (TCR). © Expert Reviews in Molecular Medicine
Homme ou souris, même maladie !
Il faut imaginer le CMH II comme une sorte de panier plus ou moins grand. En général, les CMH II ont de la place pour présenter un peptide composé de 13 acides aminésacides aminés, or le CMH II de type IAg7 est plus petit et ne peut en présenter que 9. Le peptide de l'insuline en comptant 12, il y a donc 4 façons de le placer dans le panier, en faisant dépasser quelques acides aminés d'un côté ou de l'autre. La manière de présenter ce peptide aux lymphocytes sera donc multiple.
Les chercheurs ont montré qu'une de ces présentations implique une fixation très labile entre le CMH II et le peptide : c'est cela qui pose problème. Les lymphocytes qui reconnaissent le peptide présenté de cette façon ne sont pas détruits, et sont même activés. La course à la destruction de l'insuline par auto-immunité est donc enclenchée.
Chez l'homme, le diabète de type 1 est également associé à un CMH de type II particulier. Il y a donc fort à parier que le mécanisme soit identique. L'équipe de recherche menée par le Dr. John Kappler est en train de réaliser le même type d'expérience pour valider ces résultats sur le système humain. Si tel est le cas, de nouvelles thérapiesthérapies sont à envisager : l'utilisation d'anticorpsanticorps pour renforcer l'interaction entre le CMH II et le peptide serait par exemple à tester.