au sommaire
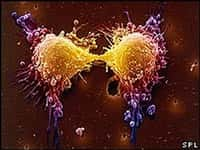
Le cancer est toujours dû à une mutation au niveau génétique qui induit un dérèglement du cycle cellulaire et conduit à un développement anarchique des cellules. Dans un cancer sur deux, la protéine p53 est affectée, que ce soit de manière directe ou indirecte. En 2008, les différentes formes de cancer ont quand même tué 7,6 millions de personnes, soit 13 % de la mortalité mondiale. © Wellcome Images, Flickr, cc by nc nd 2.0
- Tout savoir sur le cancer grâce à notre dossier complet
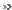
La protéine p53 est très étudiée dans la recherche contre le cancer. Découverte en 1979, elle régule finement la prolifération des cellules et déclenche selon les besoins la réparation de la cellule ou sa mort naturelle programmée (apoptose).
Contrairement aux cellules saines, le cycle des cellules tumorales s'emballe, provoquant la prolifération de cellules de manière anarchique, à l'origine du cancer. Les cellules deviennent immortelles et entraînent alors des dérégulations importantes dans l'organisme. Il y a déjà quelques années, les chercheurs ont prouvé que le gène de la protéine p53 est inactivé dans la moitié des cancers chez l'Homme. Le gène codant pour p53 a été classé comme gène suppresseur de tumeur.
Les scientifiques ont émis l'hypothèse qu'en réactivant ce gène, ils pourraient empêcher cet emballement cellulaire responsable de la formation des tumeurstumeurs cancéreuses. Mais ils découvrent plus tard que p53 est elle-même régulée par un autre acteur : la protéine Mdm2. Ils pensaient alors avoir trouvé un moyen de réactiver p53.
Protéine kinase ATM : une régulation indirecte de p53
Robin Farhaeus et ses collaborateurs de l'Inserm à l'université Paris 7 apportent dans la revue Cancer Cell un nouvel élément de compréhension des mécanismes de cancérisation : l'implication de la protéine kinasekinase ATM dans la régulation de p53 par Mdm2. « Après un dommage sur l'ADNADN, Mdm2 est nécessaire pour activer p53 et cela peut se faire grâce à l'intervention de la protéine kinase ATM » explique Robin Farhaeus, directeur de recherche à l'Inserm.
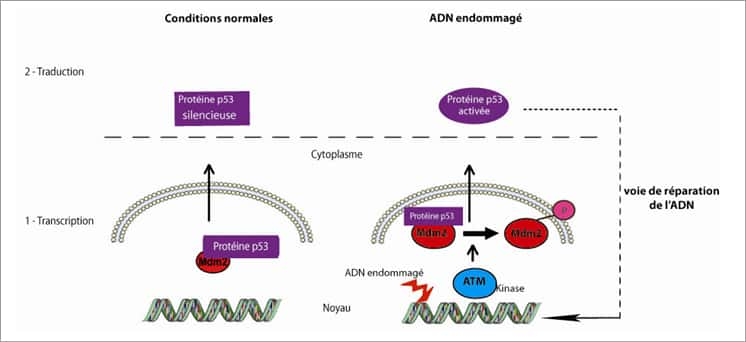
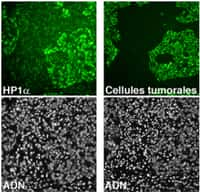
Le mécanisme de régulation de p53 est schématisé clairement ici. Quand l'ADN est endommagé, une condition favorable au développement des tumeurs, la protéine kinase ATM clive le complexe Mdm2 - p53 pour activer cette dernière. Elle va alors réparer l'ADN. © Gajjar et al., Cancer Cell
Pour réaliser cette démonstration, les chercheurs ont remonté la cascade d'événements qui déclenchent l'activation de p53. L'activation de Mdm2 est due à sa phosphorylationphosphorylation par la protéine kinase ATM, elle-même activée en cas de stress cellulaire. Cette phosphorylation de Mdm2 est cruciale pour passer d'un état de régulateur négatif à régulateur positif de p53 et favoriser ainsi son interaction avec l'ARNmARNm de p53 pour induire sa traduction. Ceci conduit à une augmentation de la quantité de p53 dans la cellule.
Cette étude aide à mieux comprendre comment les régulations respectives des protéines p53 et Mdm2 s'organisent en réponse à un dommage à l'ADN. Mieux connaître les mécanismes moléculaires spécifiques mis en place lors de stressstress cellulaire pourrait aider à établir de nouvelles approches thérapeutiques anticancéreuses.