au sommaire
L'une des thèses que Peter Diamandis soutient dans son célèbre ouvrage Abundance : the future is better than you think, est que des percées technologiques peuvent brutalement rendre disponibles des ressources en matièrematière et en énergieénergie qui semblaient à un moment destinées à rester inexploitables ou à se raréfier. Il cite l'exemple de l'aluminiumaluminium dont le prix de revient restait comparable à celui de l'or au milieu du XIXe siècle malgré l'emploi de la technique de purification du minerai due au chimiste français Henri Sainte-Claire Deville. Tout allait changer quelques décennies plus tard avec les méthodes découvertes par Paul Héroult, Charles Martin Hall et surtout Karl Bayer. Aujourd'hui les alliagesalliages à base d'aluminium sont partout, y compris en astronautiqueastronautique et en aéronautique.
L'humanité a un besoin vital de technologies de rupture en ce qui concerne l'énergie au XXIe siècle. La demande énergétique mondiale reste encore assurée à 85 % par les énergies fossiles dont on sait qu'elles sont sur le point de s'épuiser. Non seulement il ne s'agit pas d'énergie renouvelable mais elles ont aussi une empreinte carbonecarbone qui nous menace directement en étant responsable du réchauffement climatique. Plusieurs stratégies sont à l'étude pour relever les défis que représentent la découverte rapide de sources d'énergies primaires et secondaires abondantes, économiques, renouvelables et la moins polluante possible.
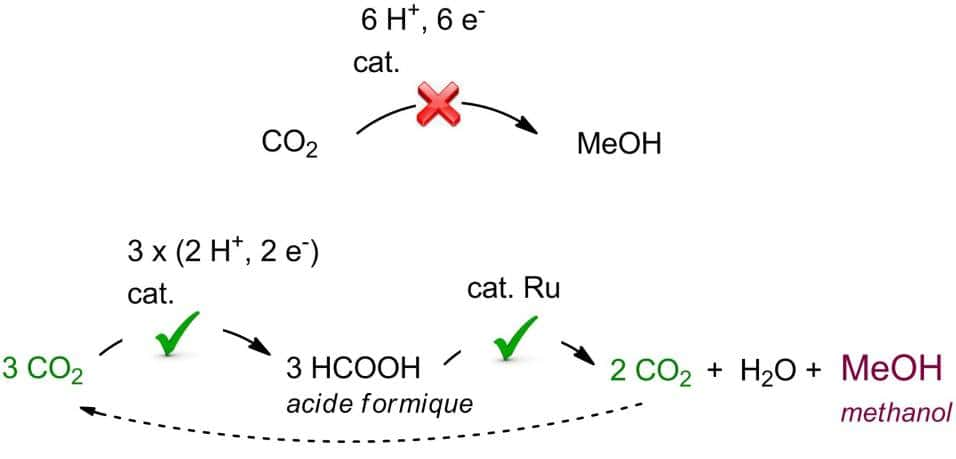
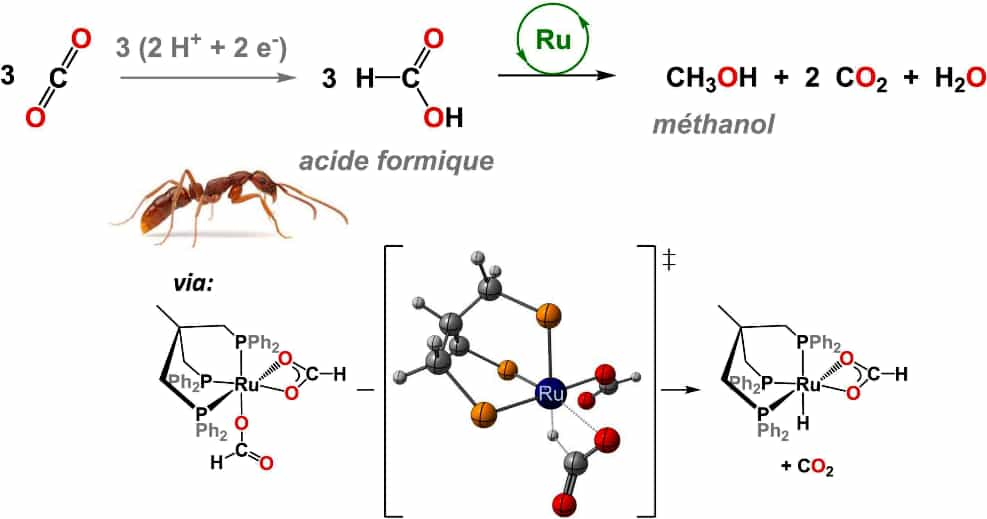
La synthèse directe du méthanol (MeO) à partie du gaz carbonique CO2 est problématique. Il faut par exemple travailler avec des hautes pressions. Une synthèse indirecte en deux étapes est préférable selon le schéma ci-dessus. Elle fait intervenir le ruthénium (Ru) comme catalyseur. © CEA
L'une de celles que les chimistes de la planète explorent avec les sources d'énergie secondaires concerne le méthanol de formule CH3OH. C'est un carburant à haute densité d'énergie et que l'on peut utiliser directement pour produire de l'électricité avec des piles à combustiblepiles à combustible à méthanol direct (DMFC pour direct-methanol fuelfuel cell en anglais) ou, bien sûr, dans des moteurs thermiquesmoteurs thermiques. Comme le méthanol peut être produit à partir du gaz carboniquegaz carbonique et qu'il libère du CO2 aussi bien en fin de réaction avec les DMFC que dans les moteurs à combustioncombustion on peut imaginer que le bilan carbonebilan carbone total de la production et de l'utilisation du méthanol soit très faible voire nul.
Le ruthénium, un catalyseur pour la synthèse du méthanol
Malheureusement, la production directe de méthanol à partir de CO2 est problématique. On s'est alors souvenu des travaux du prix Nobel de chimiechimie français Paul Sabatier qui avait découvert en 1911, une voie de synthèse du méthanol à partir de l'acideacide formique. Comme sa production à partir du CO2 est plutôt aisée, on pouvait donc envisager une voie de synthèse indirecte du méthanol à partir du gaz carbonique. Mais l'intérêt pour cette voie de synthèse n'est devenu réel qu'à partir des travaux réalisés en 2013 par les membres du groupe de K. Goldberg à l'université de Washington. Les chercheurs ont en effet découvert que l'iridiumiridium pouvait servir de catalyseurcatalyseur facile à mettre en œuvre pour le passage des moléculesmolécules d'acide formique à celles de méthanol.
La méthode avait toutefois deux limites. Le rendement de la réaction n'est que de 2 % et comme l'iridium est un métalmétal rare sur TerreTerre, le coût de la production industrielle de méthanol restait élevé. Mais voilà que des chercheurs de l'Iramis au CEA, plus précisément du laboratoire de Chimie de Coordination des Éléments f (LCCEf), viennent de faire savoir dans un article publié dans Angewandte Chemie qu'ils avaient fait une percée significative en ce qui concerne ce problème.
Ils ont en effet découvert qu'un complexe hydrure de ruthéniumruthénium permettait d'obtenir une réaction de production de méthanol à partir de l'acide formique avec un rendement de 50 %. CeriseCerise sur le gâteau, le ruthénium (Ruthénium vient du latin ruthenia qui signifie Russie), un métal apparenté au platineplatine et qui a été identifié et isolé en 1844 par le chimiste russe d'origine allemande Karl Karlovich Klaus, est dix fois moins coûteux que l'iridium.