au sommaire
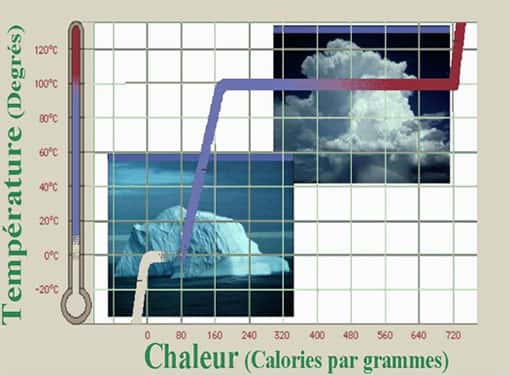
Des systèmes qui refroidissent quand on les chauffe
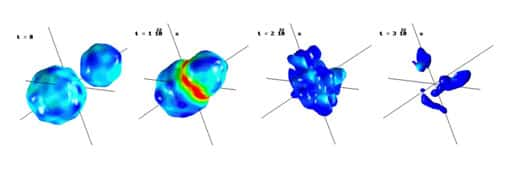
Si la présence d'un palier de température est un phénomène curieux, des développements théoriques récents suggèrent qu'au niveau élémentaire des très petits systèmes, l'anomalieanomalie du palier de coexistence apparaîtrait de façon encore plus étonnante : pendant le changement d'état - par exemple de liquide à gaz - le système refroidirait alors qu'on le chauffe, c'est à dire que sa température diminuerait quand on lui apporte de l'énergie.

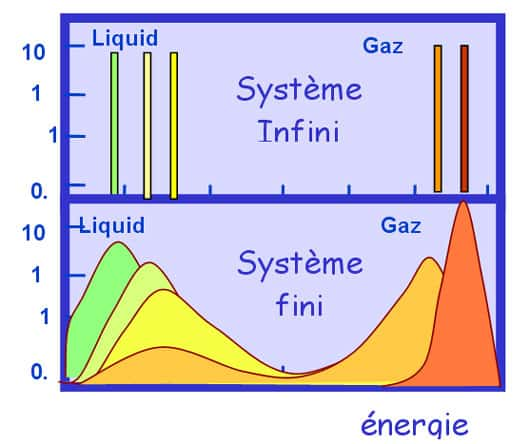
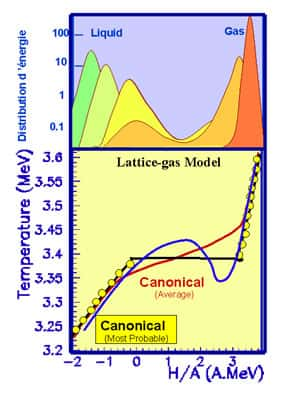
Dans les petits systèmes (ici un calcul modèle de gaz et de liquide sur un réseau contenant 200 particules), quand l'énergie par particule augmente - courbe bleue - la température (convertie en énergie après multiplication par la constante de Boltzmannconstante de Boltzmann) peut décroître lors d'un changement d'état. Si le système est placé dans un four l'énergie moyenne suit la courbe rouge alors que la plus probable saute brutalement (point jaune). Dans la zone de coexistence la distribution d'énergie (partie haute de la figure) présente deux pics correspondants aux deux phases.
La raison de cette bizarrerie est fort simple : dès que l'on veut créer une bulle de gaz dans le liquide ou une goutte de liquide dans du gaz, il faut payer le prix de l'interface, l'énergie de la surface de la bulle ou de la goutte. Ce prix énergétique est payé aux dépens de l'agitation thermique : l'interface entre deux phases fait baisser la température.
Quand le système est très grand comme un bain-marie, le coût de cette interface est marginal et vous ne remarquez pas la baisse de température. En revanche, quand le système est petit comme une infime gouttelette ou un noyau atomique, la baisse peut être importante.
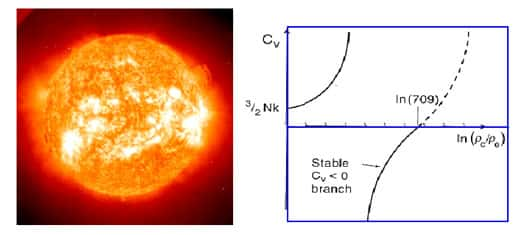
Les physiciensphysiciens caractérisent le comportement thermique d'un système par sa capacité calorifique, l'énergie qu'il faut fournir pour augmenter la température d'un degré. Lors d'un changement d'état dans un petit système, la capacité calorifique deviendrait ainsi négative.
Cette décroissance de la température lors d'un changement de phase dans un petit système a une autre conséquence étonnante. Pour une température fixe dans la zone de transition il y a deux états d'énergie possibles. L'un correspond à la première phase à basse énergie, et le second à la deuxième phase à plus haute énergie. La chaleurchaleur spécifique est négative pour des énergies intermédiaires entre les deux, ce qui correspond à une probabilité d'occurrence minimale, c'est-à-dire une instabilité. Seulement à la température de transition les deux phases pures sont exactement équiprobables, mais dans toute la zone de transitions les deux états stables restent possibles avec une différence de probabilité croissante.