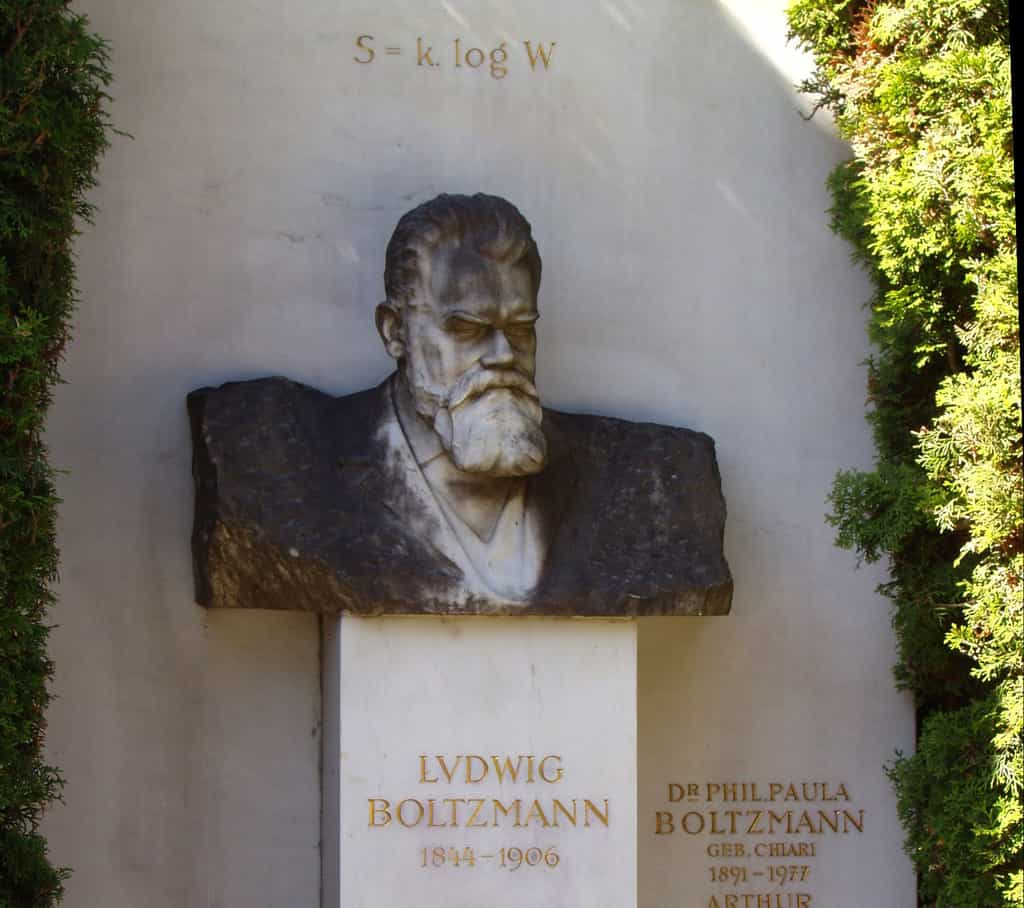au sommaire
La constante de Boltzmann fait partie des constantes fondamentales et elle revêt une importance particulière en physique statistique.
Elle se note kB, ou tout simplement k, et vaut environ 1.380649×10−23 J⋅K−1. Ainsi, comme l'entropie, la constante de Boltzmann a la dimension d'une énergie sur une température.
Constante de Boltzmann et entropie
Cette constante a été introduite pour la première fois par le physicienphysicien autrichien Ludwig Boltzmann alors qu'il cherchait à lier l'entropie d'un système thermodynamique à l'équilibre avec le nombre d'états microscopiques distincts accessibles à ce système, compte tenu des contraintes macroscopiques selon la formule :
S = k x ln Ω
où S désigne l'entropie du système et Ω le nombre d'états microscopiques
La constante de Boltzmann ne doit pas être confondue avec la constante qui apparaît dans laloi de Stefan-Boltzmannet qui définit la puissance émise par un corps noir à une température donnée.
Un lien entre énergie et température
La constante de Boltzmann peut également être interprétée, en mécanique statistique, comme faisant le lien entre la température d'un système et son énergie au niveau atomique. L'expression (½) x k x TT désigne ainsi l'énergie d'un degré de liberté en translation.
En d'autres termes, c'est l'énergie cinétiqueénergie cinétique moyenne des particules dans une direction donnée lorsque celles-ci peuvent se déplacer librement dans cette direction et lorsque le système est en état d'équilibre thermodynamique à la température T.
Constante de Boltzmann, nombre d'Avogadro et gaz parfaits
Ce lien entre le monde microscopique et le monde macroscopique est également visible dans la loi des gaz parfaitsgaz parfaits écrite de la façon suivante :
p x V = N x k x T
où p figure la pressionpression du gaz, V son volumevolume, T sa température
et N le nombre de moléculesmolécules qu'il contient
Multipliez la constante de Boltzmann par le nombre d'Avogadronombre d'Avogadro et vous obtiendrez donc la constante universelle des gaz parfaits.