au sommaire
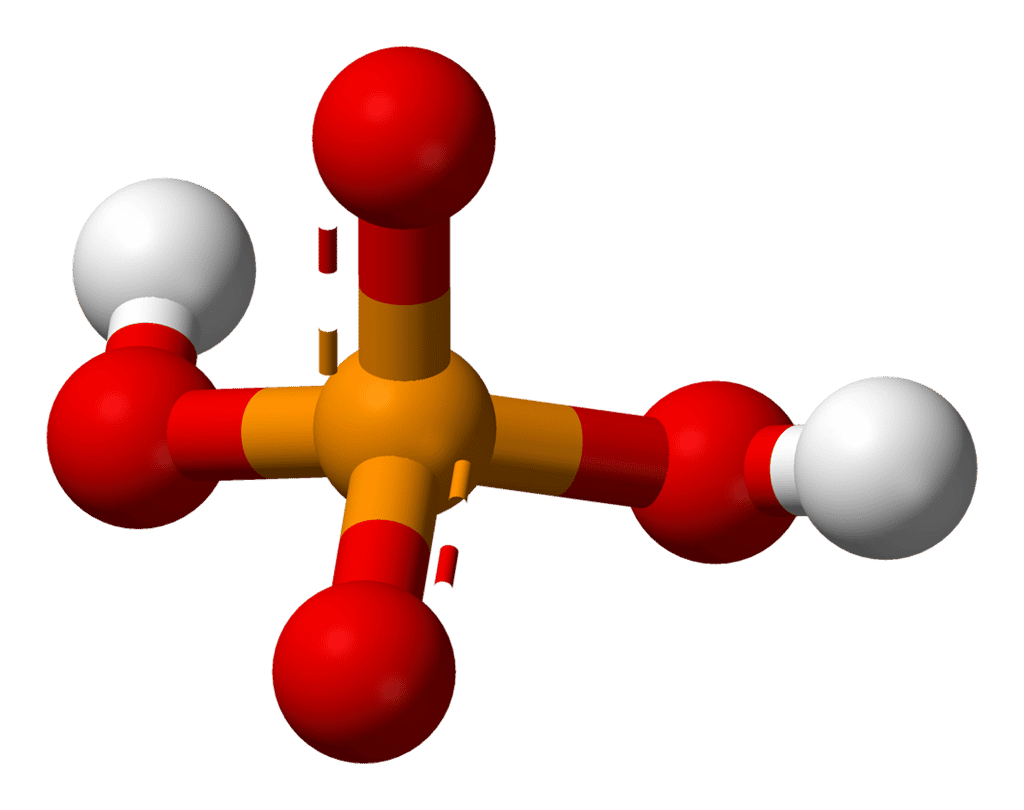
En chimie, un ampholyte est une substance se comportant à la fois comme un acide et une base, c'est-à-dire qu'elle peut céder ou capter un ion H+. Une telle substance est dite amphotère. L'eau pure est un exemple d'ampholyte : elle est la base conjuguée de l'ion hydronium H3O+ et l'acide conjugué de l'ion hydroxyle HO-. Dans la réaction acido-basique d'autoprotolyse, elle peut donc perdre un proton (H2O ⟶ H++ HO-)) ou en gagner un (H2O + H+ ⟶ H3O+).
Exemples de substances amphotères
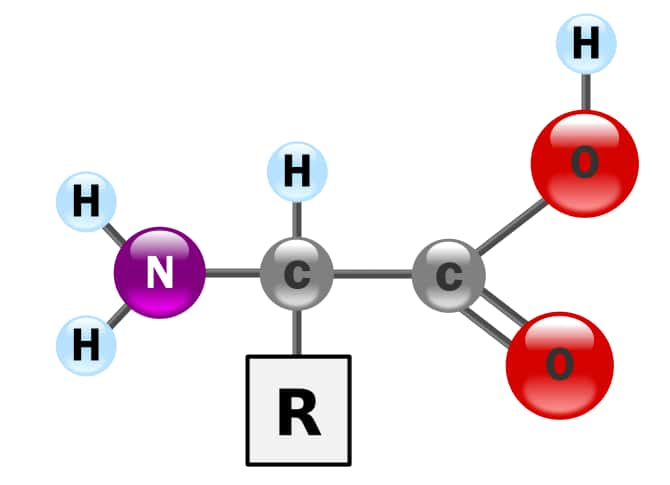
La plupart des métauxmétaux ayant plusieurs niveaux d'oxydationoxydation, les oxydes et hydroxydes de métaux sont amphotères. En solution acide, l'hydroxyde d'aluminiumaluminium Al(OH)3 se comporte ainsi comme une base en captant des ions H+ : Al(OH)3 + 3 H+ ⟶ AI3+ + 3H2O. En milieu basique, il se comporte comme un acide en cédant des ions H+ : Al(OH)3 + 2 OH- ⟶ Al(OH)4-. Les acides aminésacides aminés constituent un autre bon exemple d'ampholyte, car ils possèdent à la fois un groupe carboxylique -COOH qui est acide et un groupe aminé -NH2 qui est basique.
Applications des ampholytes
La propriété amphotère est principalement utilisée pour séparer ou doser des substances chimiques (chromatographiechromatographie par échange d'ions ou électrophorèseélectrophorèse pour les protéinesprotéines par exemple). Certains tensioactifstensioactifs amphotères comme le Cocoamidopropyl betaïne sont aussi ajoutés dans les shampoings à usage fréquent ou pour bébé afin d'atténuer l'effet décapant des tensioactifs anioniques.