Il y a une trentaine d'années, le physicien David Pritchard, a prédit l'existence d'un nouveau tour de magie quantique devant permettre de rendre parfois des atomes invisibles. Avec ses collègues, le prix Nobel de physique Wolfgang Ketterle vient de vérifier cette prédiction.
au sommaire
La révolution de la physique quantique a été initiée par les travaux de Max Planck sur le rayonnement du corps noir, mais ce qui va vraiment mener aux découvertes de Louis de BroglieLouis de Broglie, Warner Heisenberg et Erwin SchrödingerErwin Schrödinger, de 1923 à 1926, ce sont les travaux conjoints de Niels BohrNiels Bohr et Albert EinsteinEinstein sur la structure des atomes et la manière dont ils absorbent et émettent de la lumière. Ils conduiront Einstein à la découverte de l'effet laser et au fameux phénomène de condensation de Bose-Einstein qui vaudront à Wolfgang Ketterle, Eric Cornell et Carl Wieman le prix Nobel de physique de 2001.
Une présentation de la physique quantique à partir de l'histoire de sa découverte. © CEA Recherche
Des niveaux d'énergie discrets avec des règles d'occupation et de transition précises
Bohr et ses continuateurs, comme Arnold Sommerfeld, vont montrer que les raies et les bandes spectrales associées aux atomes et aux moléculesmolécules diatomiques se comprennent bien si les électronsélectrons dans ces systèmes atomiques ne peuvent exister que dans des états d'énergieénergie discrets. Ces états peuvent être caractérisés par des nombres entiers et il est possible aux électrons de passer de certains niveaux d'énergie à d'autres en émettant ou absorbant des photonsphotons. Tous les sauts quantiques ne sont pas autorisés et il existe à ce sujet ce que l'on appelle des règles de sélection.
Enfin, l'étude de ces sauts montre, comme le prix Nobel de physique Wolfgang PauliWolfgang Pauli allait le comprendre, que des électrons ne peuvent pas s'entasser sur un seul niveau d'énergie, ou dit autrement qu'il semble exister dans la nature un principe d'exclusion n'autorisant pas deux électrons dans un système atomique à posséder les mêmes nombres quantiquesnombres quantiques entiers associés à une même valeur de l'énergie pour ces électrons.
Plus récemment, on parle implicitement de ce principe lorsque l'on discute de ce qui a été appelé le blocage de Pauli et qui illustre en fait cette impossibilité pour des électrons, ou d'autres particules analogues que l'on appelle des fermionsfermions (par exemple des protonsprotons, des neutrinosneutrinos ou des quarksquarks), à occuper des états d'énergie identiques (cela ne s'applique qu'à des particules indiscernables du même genre). Le principe de Pauli est étroitement lié au fait que les fermions possèdent un moment cinétiquemoment cinétique intrinsèque que l'on appelle le spinspin, caractérisé par des nombres demi-entiers. Un électron peut alors se voir partiellement comme une sorte de toupie aimantée en rotation, mais l'analogieanalogie ne peut être poussée trop loin, notamment parce que la rotation d'une telle toupie devrait conduire à des vitessesvitesses supérieures à celles de la lumière.
(Cette vidéo est visible contrairement à ce que l'on pourrait croire). Pour modéliser le comportement de l'électron dans l'atome, un, puis trois, puis quatre nombres quantiques lui ont été affectés. Le quatrième est le spin, qui fait de l'électron « l'aimant ultime » de la matière. Un spin mesuré avec des nombres demi-entiers conduit en théorie quantique au principe d'exclusion de Pauli, responsable de ce que l'on appelle le blocage de Pauli pour des transitions quantiques. Sans cet effet, les électrons des éléments se trouveraient tous sur un même niveau d'énergie et la chimie serait bien moins complexe. © Synchrotron SOLEIL
Le principe de Pauli, une clé du comportement de la matière
Or, il y a une trentaine d'années, un physicienphysicien du célèbre MIT (Massachusetts Institute of Technology), David Pritchard, a prédit une conséquence étonnante du phénomène de blocage de Pauli avec des populations d'atomes ultrafroids se comportant comme des fermions. À l'époque, il était le mentor de Wolfgang Ketterle lorsque celui-ci est venu en tant que postdoctorant au MIT. Ce n'est donc peut-être pas un hasard si aujourd'hui le prix Nobel de physique vient de déposer sur arXiv avec ses collègues un article confirmant la prédiction de Pritchard.
Il concerne un gazgaz d'atomes de lithiumlithium refroidi par laser au point de former un groupement dense de ces atomes à une température de 20 microkelvins, soit environ 1/100.000 de la température de l'espace interstellaire. « Ce phénomène n'avait jamais été observé auparavant, car les gens n'étaient pas capables de générer des paquetspaquets d'atomes suffisamment froids et denses », explique Ketterle dans un communiqué du MIT.
Lorsqu'un autre faisceau laser tombe sur le collectif d'atomes ultrafroids, il le traverse comme s'il était presque totalement transparenttransparent et en pratique invisible. Les calculs montrent qu'en fait il le serait totalement si l'on pouvait atteindre le zéro absoluzéro absolu, ce qui est bien sûr impossible selon les lois de la thermodynamiquethermodynamique et même du point de vue de la mécanique quantiquemécanique quantique. En effet, les inégalités de Heisenberginégalités de Heisenberg interdisent à une particule d'être totalement immobile et sans mouvementmouvement, or la température d'un gaz de particules est directement proportionnelle à l'énergie cinétiqueénergie cinétique moyenne d'un gaz de particules et donc à leur état de mouvement.
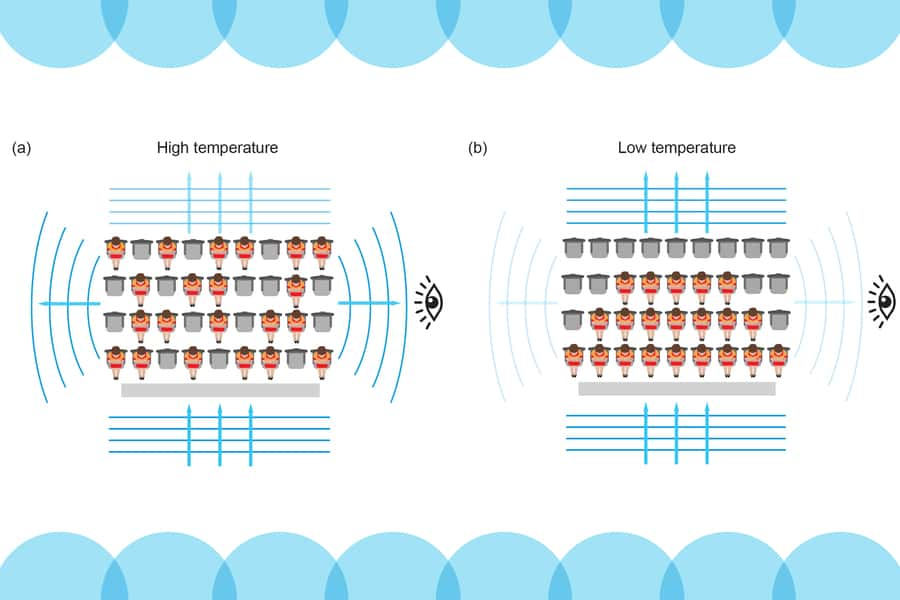
Normalement, lorsque l'on envoie des photons sur des atomes, ils sont diffusés comme le seraient des billes lancées sur une sphère « dure » et c'est pour cette raison (pour faire simple et élémentaire) que les objets sont visibles. Mais lorsque l'on refroidit un gaz d'atomes se comportant comme des fermions, tout se passe comme si on avait un gros atome avec des niveaux d'énergie quantique occupés non par des électrons mais avec les vrais atomes.
À très basse température et haute densité, les atomes tendent de plus en plus fortement à occuper complètement les niveaux d'énergie les plus bas et ils se bloquent les uns les autres en accord avec le principe d'exclusion de Pauliprincipe d'exclusion de Pauli. L'ensemble des atomes ne peut alors plus transiter d'un niveau d'énergie à un autre puisqu'en général ils sont occupés.
Un faisceau de photons ne peut donc faire que comme si les atomes n'étaient majoritairement pas là et ils ne peuvent donc être absorbés par les atomes avant que ceux-ci ne réémettent d'autres photons dans toutes les directions comme c'est d'ordinaire le cas selon les lois de la mécanique quantique.
























