au sommaire
Dans les villosités intestinales, ce gène permet de maintenir l'équilibre entre les cellules souches et les cellules différenciées, essentiel au renouvellement de ce tissu. Parallèlement un groupe néerlandais, avec lequel a collaboré l'équipe de Daniel Louvard, montre qu'en bloquant l'activité de Notch et donc en obligeant les cellules à se (re)spécialiser, il est possible de faire régresser des polypes, précurseurs des tumeurs colo-rectales, chez la souris.
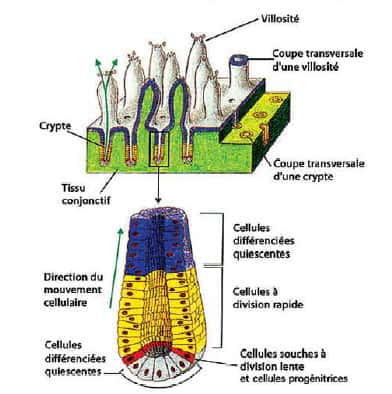
Paroi interne de l'instestin adulte : Migration des cellules épithéliales depuis leur "naissance" au fond de la crypte (cellules souchesà jusqu'à leur disparition au sommet de la villosité © Curie
Ces découvertes ouvrent de nouvelles perspectives dans la compréhension du cancer colo-rectal, notamment sur le rôle des cellules souches dans le développement tumoraltumoral, ainsi que des voies prometteuses dans le traitement d'une des tumeurs les plus fréquentes dans le monde.
Le cancer résulte d'une série d'accidentsaccidents génétiquesgénétiques qui se produisent par étapes : des anomaliesanomalies s'accumulent sur des gènes qui régulent les processus vitaux (division, différenciation, réparation, apoptoseapoptose). La perte de contrôle de la division cellulaire est l'une des caractéristiques essentielles des cellules cancéreuses. Le processus de cancérogenèsecancérogenèse peut en effet se résumer comme une perte successive des propriétés des cellules qui vont jusqu'à oublier le "travail" spécialisé pour lequel elles ont été programmées.
Les cellules tumorales retournent à un état relativement indifférencié et font en quelque sorte le cheminement inverse de celui des cellules souches qui se différencient au fil des divisions. L'étude de ce "miroirmiroir inversé" peut ainsi permettre d'améliorer la compréhension de la cancérogenèse.
Si cellule souche a longtemps rimé avec embryonembryon, on sait désormais que l'adulte en possède également une réserve. Elle participe au renouvellement quotidien des quelques centaines de milliards de cellules qui meurent dans notre organisme.
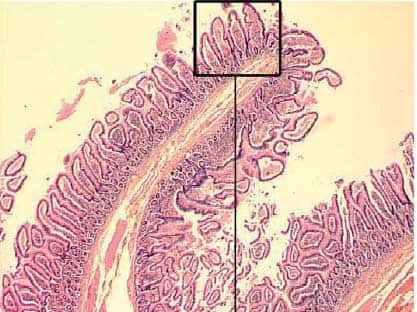
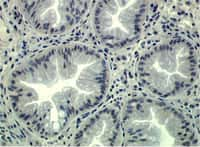
Coupe anatomorphologique de tissu intestinal humain © Curie
L'intestin, un monde cellulaire en miniature
L'intestin est constitué d'une multitude de plis serrés - les villosités - d'une hauteur de quelques centaines de cellules. Au fond des villosités se trouvent des cellules souches et des cellules progénitrices. Les cellules souches donnent naissance aux cellules progénitrices. Ces dernières relativement indifférenciées, et donc sans fonction propre, constituent une première étape entre les cellules souches et les cellules spécialisées. Elles donnent naissance aux quatre types de cellules présentes dans l'intestin. Les cellules progénitrices engendrent des cellules qui remontent le long des villosités et acquièrent progressivement leur fonction de digestiondigestion. Arrivées au sommet, ces cellules devenues spécialisées "meurent" et sont digérées. Ce cycle dure quelques heures et l'ensemble du tissu intestinal se renouvelle en 3 à 5 jours.
Des perspectives thérapeutiques prometteuses dans le cancer colo-rectal
Par ailleurs, sachant que les inhibiteurs d'y-secretase, une famille de moléculesmolécules initialement développées pour le traitement de la maladie d'Alzheimermaladie d'Alzheimer, bloquent l'activation de Notch, l'équipe d'Hans Clevers les a administrées à des souris porteuses d'un adénomeadénome coliquecolique. Les résultats obtenus montrent que ce traitement, en forçant les cellules tumorales à se spécialiser, entraîne une régression des adénomes.
Ces molécules ouvrent ainsi une voie thérapeutique prometteuse pour le cancer colo-rectal, l'une des tumeurs les plus fréquentes en France et dans le monde.
Le modèle mis au point par les équipes de Spyros Artavanis-Tsakonas et Daniel Louvard devrait permettre d'étudier plus précisément l'implication des cellules progénitrices et des cellules souches dans le développement des cancers colo-rectaux. Compte tenu de la rapiditérapidité de renouvellement du tissu intestinal (3 à 5 jours), les altérations survenant dans les cellules déjà différenciées des villosités ont peu de chance de donner naissance à des cellules tumorales. Il semblerait que seules les altérations touchant les cellules souches ou les cellules progénitrices des villosités intestinales puissent être à l'origine d'une tumeur colo-rectale.
Le modèle développé par ces deux équipes servira donc à mieux comprendre le développement de ces tumeurs, et, dans la perspective d'un traitement ciblé sur les cellules souches, le rôle et le fonctionnement de ces cellules très particulières.
L'ensemble de ces résultats ouvre de nouvelles perspectives dans la compréhension du cancer colorectalcancer colorectal et des voies prometteuses dans le traitement d'une des tumeurs les plus fréquentes dans le monde.