au sommaire
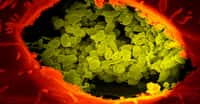
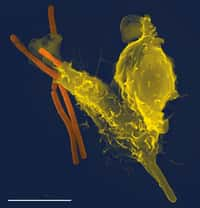
Les cellules infectées par les mycobactéries libèrent des glycolipides microbiens dans leur environnement (la composante lipidique est représentée en vert, la partie formée de plusieurs unités de glucides en jaune). Ces glycolipides sont capturés par les
Cette découverte ouvre un nouveau champ d'investigations dans le domaine de l'identification d'antigènes microbiens qui pourraient avoir une importance vaccinale.
Le détail des résultats obtenus est publié dans la revue Science datée du vendredi 25 novembre 2005.
La réponse immunitaireréponse immunitaire contre les mycobactéries, des microbesmicrobes responsables de maladies comme la tuberculose et la lèpre, est assurée par des lymphocytes TT. Ces cellules du sang reconnaissent de façon spécifique à la fois des peptidespeptides microbiens -présentés par les moléculesmolécules d'histocompatibilité-, et des glycolipidesglycolipides -présentés par les molécules CD1.
Ces glycolipides sont des composants de la paroi externe des pathogènespathogènes et sont, comme leur nom l'indique, formés d'une partie lipidique couplée à une partie glucidique qui peut être de taille variable. Quatre molécules CD1 (CD1a, b, c et d) sont connues depuis longtemps pour pourvoir fixer ces glycolipides et les exposer à la surface des cellules responsables du déclenchement de la réponse immunitaire, les cellules dendritiques.
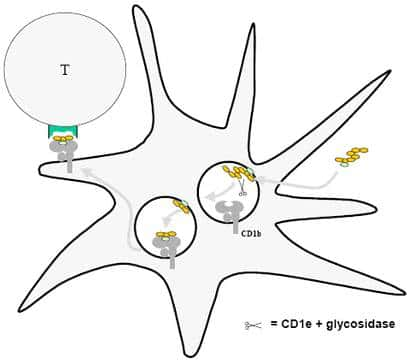
Ces complexes CD1/glycolipides sont reconnus par des lymphocytes T particuliers et cette reconnaissance entraîne toute une série d'événements immunologiques aboutissant à l'élimination des pathogènes (cf shéma).
Tous les antigènes microbiens glycolipidiques connus pour être immunogènes comprennent une tête glucidique de petite taille. Or, les microbes produisent aussi des glycolipides dont la partie glucidique est d'une taille relativement importante. Aussi l'existence de mécanismes permettant de transformer ces dernières molécules en de plus petites, reconnues par les lymphocytes T, étaient suspectés depuis longtemps. Ils viennent d'être identifiés.
L'Unité Inserm 725 « Biologie des cellules dendritiques humaines », dirigée par Daniel Hanau à Strasbourg, a réussi à identifier, grâce à une approche génétiquegénétique, un certain nombre de molécules caractéristiques de ces cellules. Parmi ces molécules, l'attention des chercheurs de l'Inserm a porté sur la molécule CD1e, une protéineprotéine demeurée longtemps mystérieuse.
Découverte 10 à 15 ans après les autres molécules CD1, elle ressemble structurellement aux autres molécules CD1. Cependant, à la différence de ces dernières, la molécule CD1e n'est pas présente à la surface des cellules mais reste intracellulaire, localisée dans des compartiments particuliers, les lysosomeslysosomes. Il s'agit de vésicules riches en enzymesenzymes hydrolytiques, où aboutissent les antigènes. Ces compartiments apparaissent donc appropriés pour assurer l'hydrolysehydrolyse des antigènes en plus petites molécules. Ces dernières molécules sont ensuite pris en charge par les molécules CD1b, c ou d qui transitent dans les lysosomes puis regagnent la surface cellulaire pour être reconnu par les lymphocytes T spécifiques.
La présence du CD1e dans les lysosomes suggérait que cette molécule puisse être impliquée dans la présentation de glycolipides par d'autres molécules CD1. Cette hypothèse vient d'être confirmée et précisée au cours du travail collaboratif entre l'Unité Inserm 725, l'Institut de Pharmacologie et de Biologie Structurale de Toulouse, et le Département de Recherche « Immunologie Expérimentale » de l'Hôpital Universitaire de Bâle.
Les chercheurs ont ainsi démontré que la molécule CD1e permet l'hydrolyse partielle, par des glycosidases lysosomales, de la partie glucidique de glycolipides de grande taille.
Ce processus permet de générer des antigènes pourvus d'une tête glucidique de plus petite taille, qui peuvent ainsi être présentés par la molécule CD1b à des lymphocytes T.
Grâce à ces travaux, le mécanisme immunologique qui aboutit à la transformation d'antigènes immunogènes à partir de molécules qui ne le sont pas par elles-mêmes est mis au jour.
Des antigènes glycolipidiques encore inconnus pourront être découverts en tenant compte de ce mécanisme. La participation de la molécule CD1e à d'autres mécanismes enzymatiquesenzymatiques dans la génération d'antigènes est envisageable. L'importance de la molécule CD1e dans le développement de la réponse immunitaire contre la tuberculose est posée. Cette découverte ouvre donc tout un nouveau champ d'investigations qui pourrait avoir des implications vaccinales ou thérapeutiques.