au sommaire
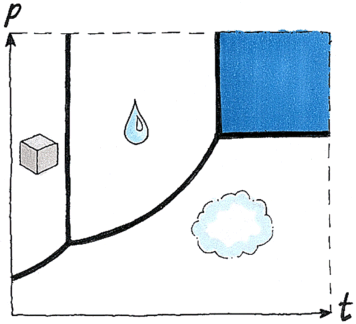
Diagramme de la phase du dioxyde de carbone
Les fluides supercritiques sont produits en chauffant un gaz au-dessus de sa température critique ou en comprimant un liquide au-delà de sa pression critique. La température critique d'une substance est la température au-delà de laquelle une phase liquide ne peut pas exister, quelle que soit la pression. La pression de vapeur d'une substance à sa température critique est sa pression critique. Quand elle se trouve à des températures et des pressions au-delà mais proches de sa température et pression critiques (le point critique), une substance est appelée fluide supercritique.
Dans ces conditions, le volume molairemolaire est le même, que la forme originale ait été liquide ou gazeuse. Les fluides supercritiques sont caractérisés par des densités, des viscosités, et d'autres propriétés qui sont intermédiaires entre celles de l'état gazeuxétat gazeux et liquide de la substance. Le dioxyde de carbonedioxyde de carbone est le fluide supercritique le plus communément utilisé en raison de sa basse température critique (31 oC), ses propriétés inertes, sa faible toxicitétoxicité et réactivité, et enfin sa haute pureté à faible coût. Le dioxyde de carbone ne dissout pas les corps composéscorps composés polaires, ainsi lors de l'analyse de ce type de corps composés on peut ajouter au dioxyde de carbone du méthanol, des étherséthers cycliques, de l'eau ou de l'acideacide formique.






















