au sommaire
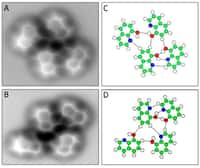
Les images des deux dimères au microscope à effet tunnel. Crédit : Kumagai et al.
Vingt fois plus faible que la liaison covalente, mais plus forte que les liaisons de van der Waals, ses cousines, la liaison hydrogène est responsable non seulement du haut point d'ébullition de l'eau mais aussi de la formation des structures tridimensionnelles des protéinesprotéines, et surtout, des liaisons entre les bases de l'ADNADN. On peut donc sérieusement la considérer comme la liaison chimique de la vie.
Bien qu'elle soit en grande partie d'origine électrostatiqueélectrostatique et de type dipôle-dipôle, il semblerait malgré tout, suite à de récentes études, qu'une partie de la liaison hydrogène soit bien une forme de liaison covalente comme l'avait proposé il y a longtemps le prix Nobel Linus Pauling. La liaison hydrogène possède en effet un caractère de directivitédirectivité semblable à celui de la liaison covalente. Il existe donc un échange entre les deux molécules d'eau et chacune d'elle tient à tour de rôle ceux d'accepteur et de donneur.
Une équipe de chimistes des Université d'Osaka et de Kyoto a utilisé un microscopemicroscope à effet tunnel pour observer ce phénomène. Les chercheurs ont considéré un dimère formé par deux molécules. Pour mettre en évidence le caractère dynamique de la liaison hydrogène, ils ont examiné deux dimères, l'un formé de molécules d'eau ordinaire et l'autre d'eau lourde, où l'hydrogène est remplacé par le deutérium, l'un de ses isotopesisotopes.
Un effet tunnel échange les rôles des deux molécules d'eau
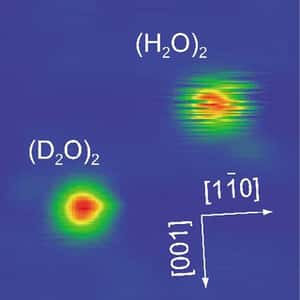
L'expérience a consisté à placer les deux types de dimères sur une surface en cuivrecuivre refroidie à 6 K. Alors que l'image du dimère contenant du deutérium, D2O, apparaît bien définie sous le microscope à effet tunnelmicroscope à effet tunnel, comme on le constate sur la photo (voir au bas de l'article), celle du dimère d'H2O apparaît peu régulière et zébrée. La raison en est que si les fluctuations causées par l'échange des rôles des deux molécules sont rapides dans le cas de D2O, elles le sont moins dans le cas de H2O. Le processus d'échange est basé sur un effet tunnel, entraînant des modifications de la position de l'atomeatome d'oxygèneoxygène. Le bilan est que les molécules d'eau se mettent à vibrer.
Une meilleure compréhension de la formation d'une liaison hydrogène devrait permettre aux chercheurs de mieux analyser son rôle dans bien des situations. Ils citent par exemple le cas des réactions catalytiques à la surface des électrodesélectrodes dans les piles à combustibles.