au sommaire
Les microtubules sont des constituants dynamiques essentiels du cytosquelette (le réseau de filaments qui sert de squelette aux cellules) impliqués dans de nombreuses fonctions cellulaires comme la division cellulaire, le trafic intracellulaire ou la croissance des neurones. Ce sont des cylindres creux formés de polymèrespolymères linéaires de tubuline, une protéine cellulaire abondante. La dynamique d'assemblage et de désassemblage de la tubuline en microtubules est contrôlée par diverses protéines, comme par exemple celles de la famille de la stathmine ; ces dernières sont impliquées dans l'intégration et le relais de voies de signalisation intracellulaire. La dynamique des microtubules peut être également contrôlée par des composés pharmacologiques, comme certains anti-cancéreux. La colchicine est un exemple de composé pharmacologique qui en se liantliant à la tubuline, empêche sa polymérisationpolymérisation en microtubules. Le mécanisme de cette inhibition demeurait incompris.
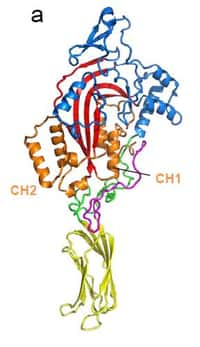
Dans le cadre d'une collaboration entre des équipes du CNRS, de l'Inserm et de l'European Molecular Biology Laboratory, la structure cristalline d'un complexe tripartite composé de tubuline, d'un ligandligand endogèneendogène : une protéine de type stathmine, et d'un composé pharmacologique : la colchicine, a récemment été déterminée. L'élucidation de cette structure permet de mieux comprendre le mode d'action de ces trois composantes dans le contrôle de l'assemblage/désassemblage des microtubules. L'analyse cristallographique a également permis de localiser le site de liaison de la colchicine, révélant le mécanisme par lequel celle-ci inhibe l'assemblage des microtubules. Enfin, ces travaux pourront également contribuer à éclairer l'étiologie de certaines pathologies et à ouvrir des perspectives thérapeutiques, notamment dans le domaine des maladies neurodégénérativesmaladies neurodégénératives ou du cancercancer.