au sommaire
Le groupe pharmaceutique Sanofi et sa filiale Genzyme ont fait état d'une amélioration ou d'une stabilisation prolongée de l'état de patients bénéficiant d'un traitement contre la sclérose en plaques au Lemtrada, dont une demande d'autorisation est en cours d'examen aux États-Unis.
L'analyse des résultats de la première année d'étude de prolongation consacrée à cette moléculemolécule « a révélé que les taux de rechuterechute et les scores d'accumulation soutenue du handicap sont restés faibles chez les patients qui avaient été traités antérieurement par Lemtrada, dans le cadre des études de phase III », indiquent-ils dans un communiqué.
Dans ces études pivots, Lemtrada a été administré à deux reprises : « au début de l'étude et 12 mois plus tard », précisent le groupe et sa filiale, tout en soulignant que « plus de 80 % des patients n'ont pas reçu de traitement supplémentaire par Lemtrada au cours de la première année de l'étude de prolongation ».
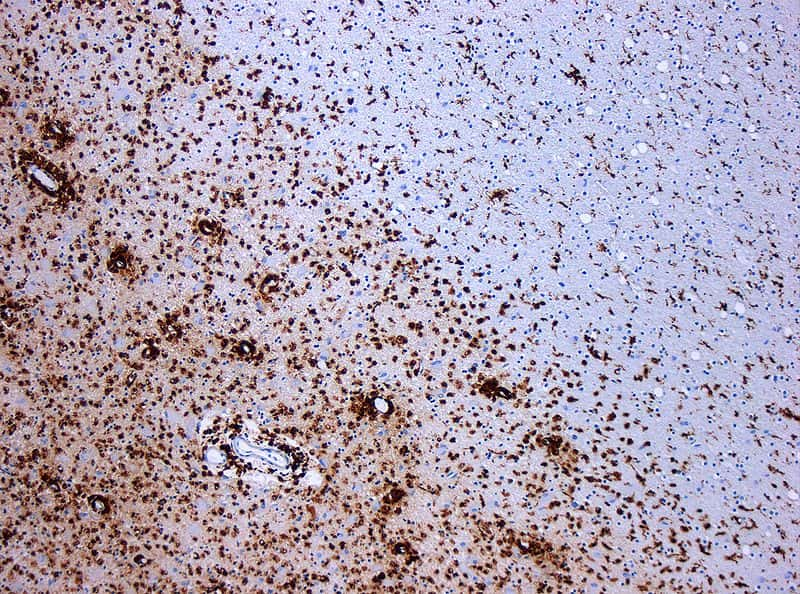
La sclérose en plaques est une maladie auto-immune inflammatoire, qui se caractérise par la perte de la gaine de myéline autour des axones des neurones, une structure permettant d'accélérer l'influx nerveux. À l'image, on peut voir en marron les macrophages attaquer le tissu nerveux. © Marvin101, Wikipédia, cc by sa 3.0
Le Lemtrada prescrit dès 2013 ?
« Ces résultats sont importants, car ils donnent à penser que les bénéfices du Lemtrada observés dans le cadre des études de phase III se maintiennent dans le temps, même si la plupart des patients n'ont pas reçu de dose supplémentaire », a indiqué le docteur Edward Fox, directeur de la clinique de la sclérose en plaques de Central Texas. Ce dernier a présenté les conclusions de l'étude au congrès annuel de l'American Academy of Neurology à San Diego (Californie).
La publication de ces résultats intervient alors même que Genzyme a présenté des demandes d'autorisation de mise sur le marchéautorisation de mise sur le marché pour le Lemtrada à l'Agence européenne des médicaments (EMA) et à la Food and Drug AdministrationFood and Drug Administration (FDA) des États-Unis. La réponse de la FDA, qui a accepté d'examiner une nouvelle demande d'autorisation formulée par la société de biotechnologiesbiotechnologies américaine, est attendue « au deuxième semestre 2013 ». Fin août 2012, elle avait rejeté une première demande de Genzyme pour des raisons administratives. L'avis de l'EMA est lui espéré au deuxième trimestre 2013.