au sommaire

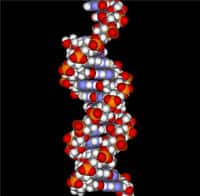
L'image prise au microscopie électronique à transmission où l'on voit apparaître la fameuse structure en double hélice de l'ADN. La photo n'est pas d'une clarté absolue mais on devine, en zoomant, cette structure caractéristique. Le trait noir représente 20 nm. © Enzo di Fabrizio
L'ADN, support de l'hérédité dans une grande partie du monde vivant, consiste en deux brins qui s'imbriquent l'un dans l'autre pour former une double hélice. Cette structure est connue depuis 1953, grâce aux travaux des célèbres James Watson et Francis Crick, qui ont réussi leur démonstration grâce à la cristallographiecristallographie aux rayons Xrayons X.
Elle repose sur le principe suivant : on forme des cristaux d'ADN sur lesquels on envoie un rayonnement X. Ces rayons sont diffractés selon certains angles avec une intensité particulière. Avec des outils mathématiques puissants, il est possible de déterminer la structure du cristal et, par extension, d'une moléculemolécule.
Pour la première fois, cette double hélice vient d'être capturée par les yeuxyeux surpuissants d'un microscope électronique à transmission, même si l'image n'est pas d'une clarté absolue, grâce à une nouvelle technique mise au point par des chercheurs italiens de l'université de Gênes.
Des tresses d’ADN double brin
La technique, nouvelle, est décrite dans Nanoletters. Elle est assez complexe. Des fragments d'ADN double brindouble brin s'agglomèrent entre eux par groupes de 7 et forment des tresses très hydrophobeshydrophobes. Ces tresses sont diluées dans une solution aqueusesolution aqueuse qui est déposée sur un revêtement de siliciumsilicium particulièrement hydrophobe également, composé de colonnes empilées les unes à côté des autres (voir l'image).

Structure en silicium utilisée pour l'expérience (vue au microscope électronique à balayage). Les tresses d'ADN se fixent sur les colonnes. Entre ces piliers microscopiques, on voit des pores par lesquels passe le faisceau d'électron nécessaire à la mise en images. Le trait blanc représente 1 µm. © Enzo di Fabrizio
Très vite, les molécules d'eau s'évaporent, laissant derrière elles les tresses d'ADN qui reposent sur les piliers microscopiques. À leur base se trouvent des pores par lesquels est envoyé un faisceau d'électronsélectrons afin d'en récolter une image (voir au bas de l'article). En zoomant un peu sur le cliché, on devine la structure en double hélice que les scientifiques cherchaient à révéler.
Un microscope électronique plus sensible
Grâce à cette avancée, les biologistes souhaitent observer de plus près les interactions entre ADN et protéines, ARN ou d'autres molécules. En outre, ils espèrent affiner encore leur méthode pour ne plus regarder une tresse de sept fragments double brin d'ADN, mais un seul.
Pour cela, les chercheurs ont besoin d'un détecteur plus sensible. En effet, ils ont dû regrouper les molécules entre elles pour qu'elles résistent aux niveaux d'énergieénergie des électrons envoyés dans le faisceau. Sans cela, l'ADN aurait été fracturé et les auteurs n'auraient rien observé. Il leur faut donc un microscopemicroscope capable de détecter des électrons dotés de niveaux énergétiques inférieurs pour ainsi immortaliser la première image d'un seul et unique fragment d'ADN double brin.