Les plus puissants des microscopes nous avaient déjà offert des images d’atomes individuels. Mais sans permettre d’en identifier la nature. Pour cela, les physiciens avaient besoin de pouvoir les radiographier. Les passer aux rayons X. C’est désormais chose possible.
au sommaire
Les rayons X, on s'en sert dans les aéroports, pour scanner les bagages. Mais aussi dans les hôpitaux, pour repérer des os cassés. La Nasa en a équipé le rover CuriosityCuriosity pour lui permettre d'analyser la composition des roches martiennes. C'est l'une des utilisations des rayons X les plus importantes aujourd'hui. Une équipe de chercheurs dirigée par un physicien de l’université de l’Ohio (États-Unis) vient de réaliser en la matière, une avancée spectaculaire en réussissant à radiographier un seul atome.
Précisons que, jusqu'ici, la sensibilité des instruments ne permettait pas de sonder des échantillons de moins d'un attogramme. Comprenez de moins de 10-18 grammes. C'est infime. Mais cela représente tout de même quelque 10 000 atomes. On comprend mieux pourquoi les scientifiques parlent de « rêve qui devient réalité ».
“Cette découverte transformera notre monde”
« Les atomes peuvent être imagés en routine avec des microscopesmicroscopes à balayage, mais sans rayons X, on ne peut pas dire de quoi ils sont faits. Nous pouvons désormais détecter exactement le type d'un atome particulier, un atome à la fois, et mesurer simultanément son état chimique », se réjouit Saw Wai Hla, physicienphysicien à l'université de l'Ohio, dans un communiqué. « Cette technologie pourrait révolutionner la recherche et donner naissance à de nouvelles technologies dans des domaines tels que l'information quantique et la détection d'éléments traces dans la recherche environnementale et médicale, pour n'en nommer que quelques-uns », complète Tolulope Michael Ajayi, premier auteur des travaux. « C'est incontestable, cette découverte transformera notre monde », renchérit Saw Wai Hla.
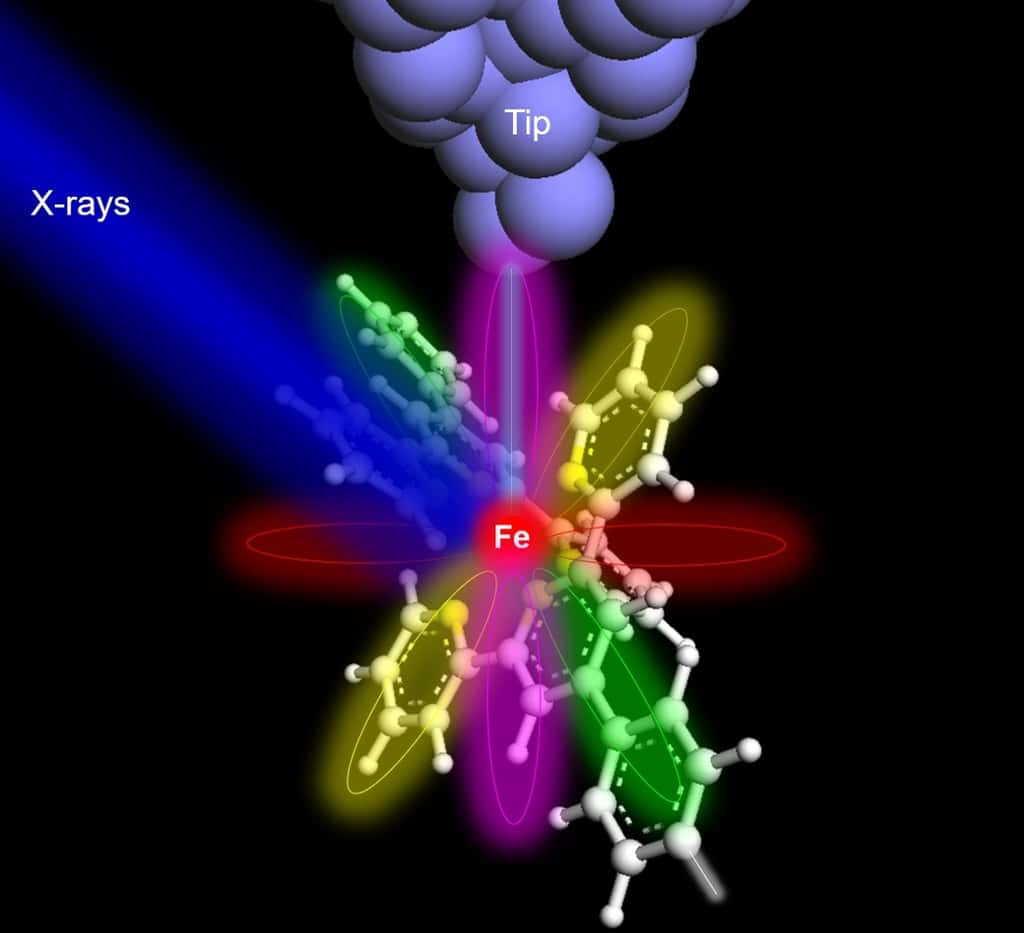
Ces informations tirées de la première image aux rayons X d’un atome
Pas moins de douze ans que le physicien travaille au développement de cette technologie. Le chemin a été long. On comprend son enthousiasme.
Ceux que les chercheurs sont finalement parvenus à identifier, ce sont un atome de ferfer (Fe) et un atome de terbiumterbium (Tb) insérés dans des moléculesmolécules. Le tout grâce à une installation spécialement conçue dans cette optique. Parce que le rayonnement X d'un atome seul est extrêmement faible, les chercheurs ont amélioré les détecteurs existants en positionnant une pointe métallique à proximité immédiate de l'échantillon. Pour collecter plus efficacement les électronsélectrons excités par les rayons X. Les scientifiques qualifient la technique de microscopie à effet tunnel à balayage synchrotron X (SX-STM).
La motivation première des chercheurs de l'université de l'Ohio était de mettre au point un moyen de réussir à comprendre les propriétés chimiques et physiques des matériaux au niveau fondamental. Sur la base d'un atome individuel. En plus d'obtenir la signature aux rayons X d'un atome, l'objectif principal était ainsi d'utiliser cette technique pour étudier l'effet de l'environnement sur un seul atome de terre rare. « Nous avons également détecté les états chimiques d'atomes individuels, précise Saw Wai Hla. Et en comparant les états chimiques d'un atome de fer et d'un atome de terbium à l'intérieur d'hôtes moléculaires, nous constatons que le second, un métalmétal du groupe des terres raresterres rares, est plutôt isolé et ne change pas d'état chimique alors que le premier interagit fortement avec son environnement ».









