au sommaire
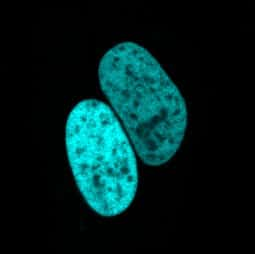
Image d'une cellule dont le noyau est rendu visible grâce à mTurquoise2. © J. Goedhart et Nature Communications
Les protéines fluorescentes cyan (CFP) sont très utilisées en biologie cellulaire car elles visualisent les processus à l'œuvre à l'intérieur d'une cellule et les changements de conformation des moléculesmolécules biologiques. Elles permettent, depuis le début des années 1990, d'observer des événements auparavant invisibles, comme le développement des cellules nerveuses dans le cerveau ou la propagation des cellules cancéreuses dans le corps. Cependant, ces molécules ont longtemps souffert d'un signal de fluorescence faible, convertissant à peine 36 % de la lumière bleuelumière bleue incidente en lumière cyan.
Afin de pallier ce problème et d'améliorer la technique, l'équipe dirigée par Antoine Royant de l'institut de Biologie structurale (IBS, CNRS/CEA/université Joseph FourierJoseph Fourier) et les chercheurs des universités d'Amsterdam et d'Oxford et de l'ESRF (European Synchrotron Radiation FacilityEuropean Synchrotron Radiation Facility) ont collaboré à un travail de recherche en trois étapes.
Dans un premier temps, l'équipe de Grenoble, avec celle d'Oxford, a décelé grâce aux rayons Xrayons X du synchrotron ESRF d'infimes détails qui ont permis d'expliquer comment les CFP stockent l'énergieénergie incidente avant de la réémettre sous forme de lumière fluorescente. Les chercheurs ont produit des cristaux microscopiques de ces CFP améliorées, les ont soumis aux rayons X du synchrotron ESRF, et ont ainsi pu inspecter le chromophore, le « cœur » de la CFP à l'origine de l'émissionémission de lumière et donc responsable de l'efficacité de fluorescence. Ils ont pu comprendre la fonction de différents atomesatomes individuels à l'intérieur des CFP et identifier la partie de la molécule qui avait besoin d'être modifiée pour augmenter le signal de fluorescence.
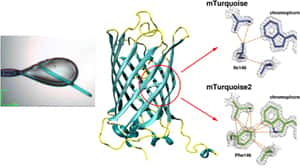
Cristal de CFP utilisé dans l'étude (échelle : 100 microns) et zoom sur la partie de la protéine proche du chromophore montrant l'amélioration de stabilisation dans mTurquoise2 qui explique sa meilleure efficacité de fluorescence. © D. von Stetten, A. Royant & Nature Communications
Une lumière brillante pour des réactions rapides
En parallèle, l'équipe d'Amsterdam dirigée par Theodorus Gadella s'est servie d'une technique de criblage innovante pour étudier des centaines de molécules CFP modifiées, mesurant leur duréedurée de vie de fluorescence au microscopemicroscope, afin d'identifier les polypeptides dont les propriétés avaient été améliorées.
Le résultat de cette conception rationnelle est une nouvelle CFP, appelée mTurquoise2. En combinant leurs efforts de biologie structurale et cellulaire, les chercheurs ont pu montrer que mTurquoise2 avait un niveau de fluorescence de 93 %, jamais atteint jusqu'ici pour ce type de protéine.
Cette nouvelle molécule permettra d'étudier les interactions entre protéines à l'intérieur de cellules vivantes avec un niveau de sensibilité inégalé. La haute sensibilité est cruciale pour les réactions rapides où le temps nécessaire pour l'accumulation de la lumière fluorescente est très court et dans des processus biologiques où quelques protéines seulement sont impliquées et les signaux extrêmement faibles. Grâce à cette nouvelle protéine, de nombreuses recherches pourront être réalisées avec des niveaux de précision et de détail jamais égalés. Par cette nouvelle approche basée sur la connaissance de la dynamique structurale de la protéine, les chercheurs espèrent maintenant concevoir des protéines fluorescentes améliorées avec des couleurscouleurs différentes pour d'autres applicationsapplications.
Ces travaux font l'objet d'une publication dans la revue Nature Communications du 20 mars.