au sommaire
Le gaz carbonique, dont la formule brute CO2 et de nom IUPAC dioxyde de carbonedioxyde de carbone, est un gaz incolore.

Propriétés du gaz carbonique
- Masse moléculaire 44,01 g.mol-1
- Température de fusion -78,5 °C (195 K)
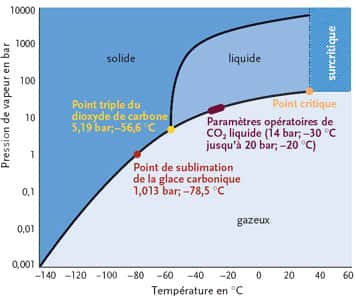
- Température de vaporisation -57 °C (216 K), pressurisé
- Température critiqueTempérature critique 31,1 °C
- Pression critiquePression critique 7,4 MPa
- Point triplePoint triple -56,6 °C à 519 kPa
- Solubilité 1,45 kgkg.m-3
- Densité 1,87 kg.m-3 (gaz à 298K 1,013 barbar) donc PLUS dense que l'airair
- ViscositéViscosité 0.07 cP à - 78 °C
- ChaleurChaleur latente de vaporisation (0 °C) 234,5 kJ.kg-1
- Chaleur latente de vaporisation (-16.7 °C) 276,8 kJ.kg-1
- Chaleur latente de vaporisation (-28.9 °C) 301.7 kJ.kg-1
- Chaleur latente de fusion (à -56,6 °C) 199 kJ.kg-1
Le gaz carbonique, aussi appelé dioxyde de carbone, est inodore et incolore
Dans les conditions normalesconditions normales, c'est un gaz incolore, inodore et à la saveur piquante, présent dans l'atmosphèreatmosphère à 0,0375 % en volumevolume, soit 375 ppmv (parties par million en volume). Mais l'augmentation est de 2 ppmv/an, de par les activités humaines de consommation des combustiblescombustibles fossilesfossiles : charboncharbon, pétrolepétrole, gaz. C'est un gaz à effet de serre.
En respirant, nous exhalons du CO2, de même que le pot d'échappement d'un véhicule à moteur ou la cheminéecheminée d'une maison. Ce gaz résulte de la combinaison de l'oxygèneoxygène avec des combustibles :
- dans notre cas, il s'agit des aliments ;
- dans le cas d'un véhicule, il s'agit d'essence ou de gazole ;
- dans le cas d'une maison, il s'agit de mazoutmazout.
Mais ce peut être aussi le gaz naturelgaz naturel, le charbon ou le boisbois.
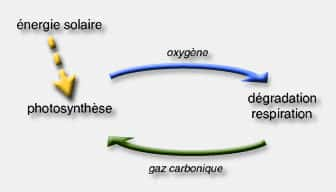
La vie, telle que nous la connaissons, n'existerait pas au sein de la biosphèrebiosphère sans la photosynthèsephotosynthèse. Inversement, l'anhydrideanhydride carbonique est produit par la respiration animale et celle des végétaux, ainsi que par la combustioncombustion des produits d'origine organique (bois, dérivés du pétrole, charbon...) et par leur décomposition.
Le rôle joué dans l'atmosphère par ce corps purcorps pur composé qu'est le CO2 est donc sans commune mesure avec sa composition volumétrique, de l'ordre de 0,03 % par rapport à l'air sec (et le place au quatrième rang des constituants de l'air).
Face à ces « sources » de CO2 atmosphérique, les zones végétales ne forment pas un véritable « puits », dans la mesure où le bilan entre l'émissionémission de gaz carbonique la nuit et la restitution d'oxygène le jour semblent s'équilibrer. Il n'en va pas de même pour l'eau liquideliquide, qui dissout le gaz carbonique : aussi les océans sont-ils considérés comme un puits de CO2.
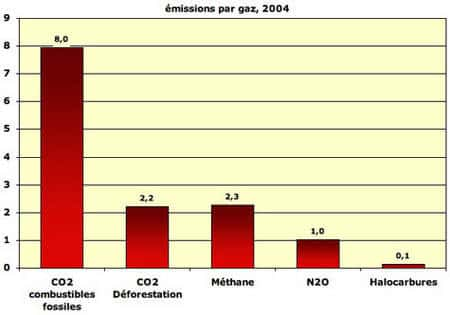
Le taux de gaz carbonique dans l'atmosphère sur les 400.000 dernières années a pu être reconstitué, grâce aux « carottescarottes » de glace prélevées en AntarctiqueAntarctique et au Groenland. Ce taux montre des variations normales mais il apparaît que la teneur en CO2 a augmenté de 30 % ces 150 dernières années.
DuréeDurée de séjour approximative dans l'atmosphère de quelques gaz à effet de serregaz à effet de serre :
- gaz carbonique (CO2) : 100 ans ;
- méthane (CH4) : 12 ans ;
- protoxyde d'azoteprotoxyde d'azote (N2O) : 120 ans ;
- halocarbures jusqu'à 50.000 ans.
Découvert vers 1638 par Jan Baptist van Helmont, il fut isolé par Joseph Priestley en 1766 et en 1776, Lavoisier mit en évidence que ce gaz est le produit de la combustion du carbone avec le dioxygène.























