au sommaire
La liaison hydrogène est une liaison chimique intermoléculaire. Comme son nom l'indique, cette liaison implique forcément un atome d’hydrogène.
Liaisons hydrogène et forces de Van der Waals
Parmi les molécules polaires, celles qui comportent des atomes d'hydrogène présentent parfois des interactions plus fortes que celles des forces de Van der Waals.
L'atome d'hydrogène « fait alors le pont » -- la longueur de la liaison hydrogène est de 200 picomètres environ -- entre deux atomes ou plus. Pourtant, il ne possède qu'un seul électronélectron. Cette liaison hydrogène n'est donc pas une liaison ordinaire. Elle est plus faible qu'une liaison covalenteliaison covalente, mais directionnelle tout comme elle. De nature électrostatiqueélectrostatique, elle ne se manifeste qu'avec des atomes très électronégatifs.
Une liaison hydrogène peut s'établir entre un atome d'hydrogène lié par covalence à un atome A très électronégatif -- comme le fluorfluor (F), l'oxygèneoxygène (O) ou l'azoteazote (N) -- et un atome B très électronégatif porteur d'un doubletdoublet non liantliant.
Exemples de liaisons hydrogène : eau, acides, Kevlar
La liaison hydrogène pourrait être renommée la liaison de la vie tant elle joue un rôle fondamental dans les processus biologiques.
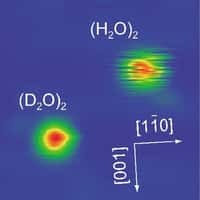
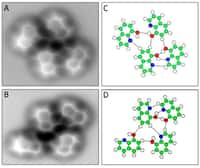
On peut observer des liaisons hydrogène entre les molécules d’eau. Chaque molécule d'eau peut même établir jusqu'à quatre liaisons hydrogène, ce qui confère à l'eau ses propriétés physiques et chimiques hors du commun.
On peut également observer entre des molécules d'acidesacides ou encore, entre les molécules polymériques du KevlarKevlar.
Des liaisons hydrogène au cœur des molécules
Il peut aussi arriver que des liaisons hydrogène s'établissent entre atomes d'une même molécule.
Dans l'exemple de l'acide acétylsalicylique, comprenez l'aspirine, il se forme une liaison chimique entre les atomes d'hydrogène et d'oxygène des groupements alcoolalcool et cétonecétone. Cette liaison retient la rotation de ces groupements fonctionnels. Elle permet également de rendre l'hydrogène moins sensible aux interactions avec d'autres molécules et réduit ainsi l'acidité de l'acide acétylsalicylique.