au sommaire
Communiqué du CNRS paru le 12 novembre 2015
Le travail posté ou des voyages aériens longs et fréquents sont des conditions socioprofessionnelles devenues fréquentes. Ces situations provoquent des expositions à la lumièrelumière pendant la période habituelle de repos, ainsi que des horaires de sommeil et de repas irréguliers. De nombreuses études épidémiologiques montrent que de telles conditions de désynchronisation circadienne favorisent l'apparition de troubles métaboliques, tels que le diabète de type 2, l'obésité et les maladies cardiovasculaires.
Chez les rongeursrongeurs nocturnesnocturnes, l'altération expérimentale des rythmes circadiens a été souvent associée à une adiposité augmentée, une intolérance au glucose et une diminution de la réponse immunitaireréponse immunitaire. Cette observation est intrigante car ces mêmes symptômes sont typiquement observés lors du vieillissement biologique. En effet, des perturbations circadiennes à long terme ou des déficiences génétiques affectant les horloges circadiennes conduisent à une espérance de vie raccourcie des rongeurs. Ces observations suggèrent que la désynchronisation des horloges circadiennes pourrait accélérer les mécanismes de vieillissement, qui, à leur tour, participeraient à l'apparition de troubles métaboliques.
Pour tester cette hypothèse, une équipe de l'institut des Neurosciences cellulaires et intégratives a choisi d'étudier le rat roussard (Arvicanthis) en collaboration avec une équipe d'écologistes de l'institut Pluridisciplinaire Hubert Curien, spécialisée dans l'étude de la diversité et de l'évolution des longévités animales. Ce rongeur diurnediurne est élevé au Chronobiotron de Strasbourg, une plateforme d'expérimentation animale spécialisée dans l'étude des rythmes biologiques. L'intérêt expérimental du rat roussard réside dans le fait que les rongeurs diurnes, actifs durant la journée comme les humains, sont de meilleurs modèles animaux que les rongeurs nocturnes habituellement utilisés pour étudier les liens entre pathologiespathologies humaines et rythmes circadiensrythmes circadiens.
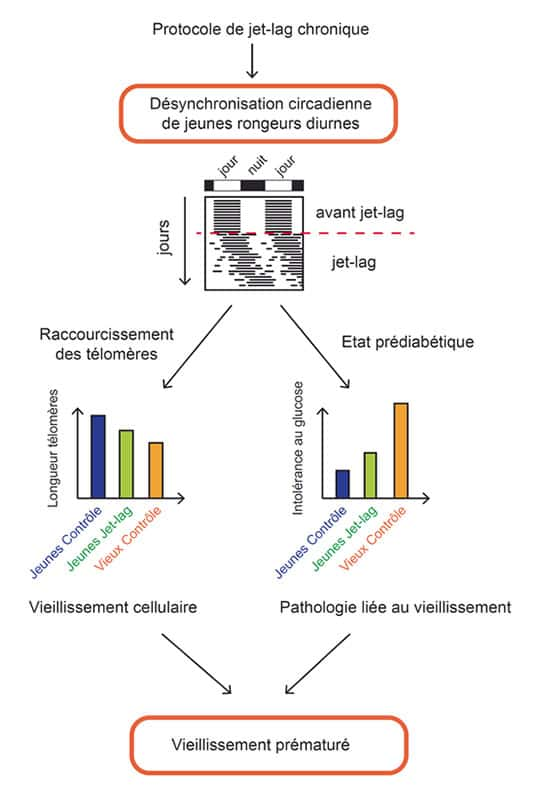
Représentation schématique de l’impact du « jet-lag » (décalage horaire) chronique sur le vieillissement d’un rongeur diurne. La désynchronisation est induite par un protocole de jet-lag chronique qui consiste en une perturbation du cycle lumière-obscurité pendant trois mois. La désynchronisation est mesurée grâce à l’enregistrement de l’activité des animaux (représentation schématique sous forme d’actogramme, où chaque barre noire représente une période d’activité). Il en résulte une diminution des télomères, signe de vieillissement cellulaire, et un état prédiabétique caractérisé par une intolérance au glucose (représentation schématique des différences obtenues). © Edith Grosbellet
Des raccourcissements précoces des télomères
Les équipes strasbourgeoises démontrent qu'un décalage horaire chronique (modification bihebdomadaire des cycles lumière obscurité) pendant trois mois consécutifs seulement, provoque à la fois un état prédiabétique (intolérance au glucose) et des changements cellulaires normalement observés au cours du vieillissement biologique. Plus particulièrement, il s'agit d'un raccourcissement précoce de la longueur d'une séquence spécifique de l'ADNADN située au niveau des télomèrestélomères qui protègent les extrémités non-codantes des chromosomeschromosomes et qui sont perdus progressivement avec l'âge. Autrement dit, ces résultats révèlent que la désynchronisation circadienne entraîne un vieillissement cellulaire prématuré.
Parmi les pistes mécanistiques étudiées, le raccourcissement des télomères chez les animaux désynchronisés ne semble pas attribuable à une augmentation du stress oxydatifstress oxydatif. En revanche, l'expression de sirtuinesirtuine 1 (SIRT1), une enzymeenzyme impliquée dans de nombreux processus intracellulaires et qui possède le double rôle d'interagir avec les horloges circadiennes moléculaires et de protéger les télomères, est réduite. Ainsi, chez les animaux jeunes soumis à la désynchronisation circadienne expérimentale, SIRT 1 est présente à un niveau intermédiaire entre les animaux jeunes et les animaux âgés, non-désynchronisés. La diminution de l'expression de SIRT1 fournit donc une première explication plausible du raccourcissement accéléré des télomères chez les animaux désynchronisés.
Des recherches complémentaires seront nécessaires pour mieux comprendre la nature exacte des mécanismes mis en jeu, mais ces travaux publiés dans la revue FASEB Journal ouvrent maintenant la voie à une étude approfondie des acteurs cellulaires et moléculaires impliqués dans l'impact de la désynchronisation circadienne sur le vieillissement. Ils soulignent également la nécessité de développer des traitements préventifs chez les personnels sujets à des désynchronisations chroniques des rythmes circadiens.
























