au sommaire
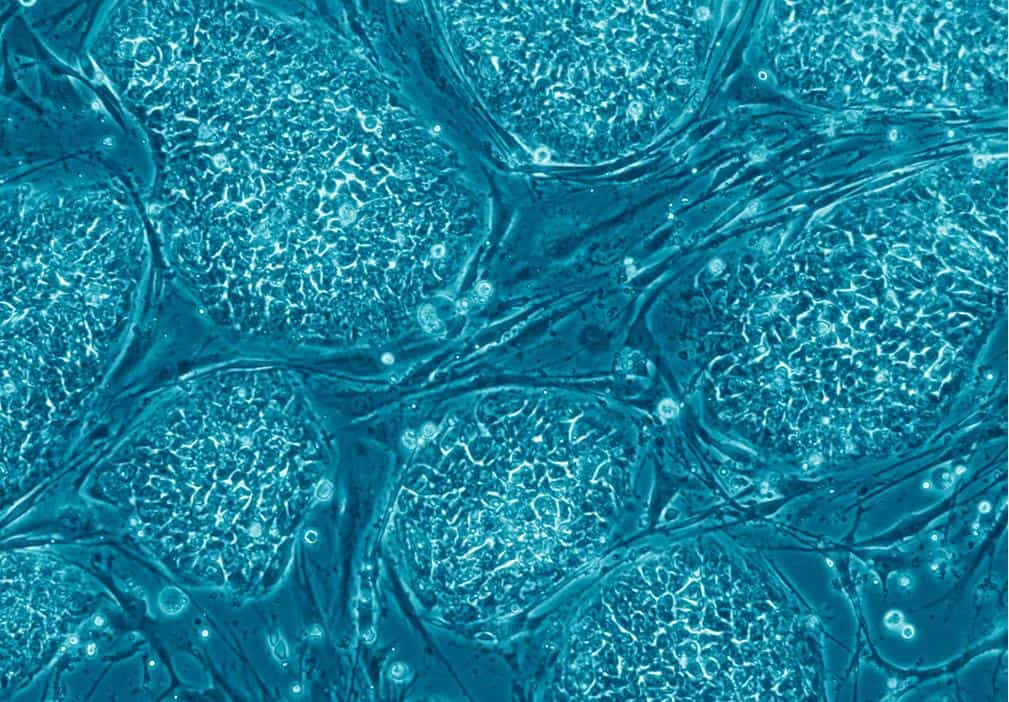
Certains en ont douté, mais ils l'avaient bel et bien fait. Il y a un an, en mai 2013, une étude menée par Shoukhrat Mitalipov, de l'université de la santé et des sciences de l'Oregon (OHSU, États-Unis) aboutissait aux premières cellules souches embryonnaires obtenues par clonage thérapeutique, à partir de cellules provenant d'un nouveau-né de huit mois. Une petite révolution qui avait été doucement contestée, puisqu'un anonyme avait repéré quelques anomalies dans les figures. Le premier concerné se défendait de toute fraude scientifique, dans un domaine de recherche qui n'en est pas exempt : il n'y a qu'à se rappeler de l'annonce des membres raëliens de Clonaid en 2002, pour laquelle aucun élément probant n'a été apporté, ou de la duperie avérée du chercheur coréen Hwang Woo-suk en 2004.
Se posait alors une question : pourquoi réussir avec un bébé et toujours échouer avec des adultes ? La qualité cellulaire déclinant avec le temps, certains scientifiques pensaient que seules les cellules les plus jeunes pouvaient supporter la manipulation. Mais c'était avant que Robert Lanza, responsable scientifique de la société Advanced Cell Technology et épaulé par des chercheurs de l'université de Séoul (Corée du Sud), réussisse cette performance, confirmant ainsi le bien-fondé des résultats de Shoukhrat Mitalipov et allant même un peu plus loin, comme montré dans la revue Cell Stem Cell.
Des embryons obtenus depuis des cellules adultes
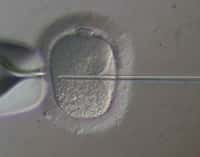
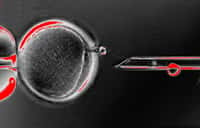
Le principe est simple à comprendre, mais difficile à mettre en place. Des cellules de la peau sont prélevées chez des volontaires. Le noyau est retiré et inséré dans un ovocyte préalablement énucléé issu d'une donneuse. On obtient donc un genre d'embryon, non issu de la fusionfusion de deux gamètes, dont il est malgré tout possible de provoquer les divisions par stimulation via un courant électriquecourant électrique. Reprenant la subtilité du protocoleprotocole de Shoukhrat Mitalipov, un supplément de caféinecaféine est ajouté afin de mieux stabiliser le système biologique.
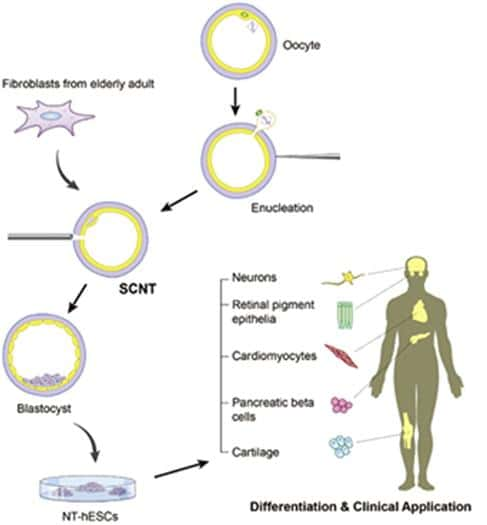
Ce schéma récapitule la méthode utilisée. Après énucléation (enucleation) de l’ovocyte (oocyte), on insère le noyau d’une cellule somatique (ici, cellule de peau adulte, fibroblast from elderly adult) dans le gamète féminin par les techniques de transfert nucléaire (SCNT). Après deux heures d’attente, les divisions cellulaires sont stimulées, jusqu’au stade blastocyste (blastocyst), à partir duquel on peut récupérer les cellules souches embryonnaires (NT-hESC), utiles pour réparer n’importe quel tissu de l’organisme. © Chung et al., Cell Stem Cell
Mais une différence demeure malgré tout par rapport à l'expérience de leur collègue de l'Oregon. En tout, les manipulations ont été effectuées sur 77 ovocytes : 38 ont été stimulés 30 minutes après l'injection du noyau, et les 39 autres ont subi le choc deux heures après la mise en contact. Les auteurs ont supposé qu'augmenter les délais conférerait à l'ADN davantage de temps pour s'acclimater à son nouvel environnement et améliorerait ainsi l'efficacité de cette technique de clonage.
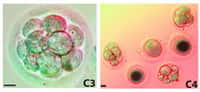
Bingo ! Dans le premier cas de figure, aucune cellule n'a pu franchir les étapes souhaitées, jusqu'au stade blastocysteblastocyste. En revanche, 2 embryons du groupe des 39 sont arrivés au terme du processus : l'un était issu d'une cellule de la peau d'un homme de 35 ans, l'autre provenait d'un senior de 75 ans, tandis que les deux ovocytes avaient été donnés par une même femme. Les scientifiques ont alors pu extraire les cellules souches embryonnaires, les seules cellules naturellement capables de se différencier en n'importe quel tissu.
Le clonage thérapeutique, l’alternative aux cellules souches induites
Certes, le taux de réussite (5 %) est faible, mais cette découverte révèle que le processus est faisable. Dans quel but ? C'est là que les inquiétudes surviennent. Pourra-t-on faire naître un être humain cloné ? La communauté scientifique se veut rassurante et estime que nous ne possédons pas encore les moyens techniques pour réussir une telle performance. Ainsi, de telles recherches permettent d'outrepasser les limites éthiques du prélèvement de cellules souches dans des embryons humains, impliquant la destruction de l'embryon. Et même mieux !
Avec la médecine régénérative, les scientifiques espèrent réparer des organes défaillants directement à l'aide de ces cellules pluripotentes. La première technique validée, basée sur des fécondations in vitrofécondations in vitro, demeure imparfaite car le génomegénome des cellules injectées est différent de celui du receveur. Or, par cette technique de clonageclonage thérapeutique, les scientifiques pensent s'affranchir du problème de rejet, et ainsi offrir une alternative plus intéressante.
Néanmoins, il faut rappeler qu'une autre voie suscite beaucoup d'espoir : celle des cellules souches pluripotentes induitescellules souches pluripotentes induites, qui ont valu un prix Nobel de médecine à son instigateur, Shinya Yamanaka. Par quelques opérations génétiquesgénétiques, des cellules de la peau redeviennent pluripotentes. Cette technique va être testée grandeur nature chez des êtres humains et a donc un temps d'avance. Mais elle pourrait ne pas être exempte de risques, notamment de mutations induisant le cancercancer. Il est donc bienvenu de disposer d'une troisième solution.