au sommaire
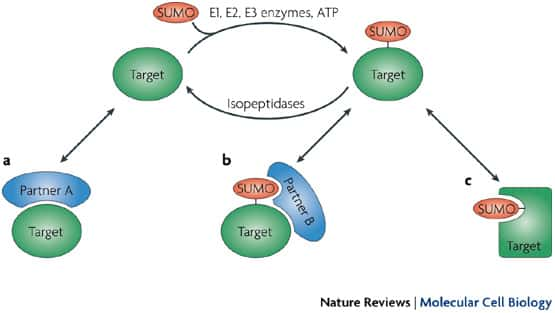
La sumoylation entraîne une modification de la protéine cible. a) la protéine non sumoylée peut interagir avec le partenaire A, b) la protéine sumoylée peut interagir avec un nouveau partenaire B, mais plus avec A, c) la protéine change de conformation et n'interagit plus. © Nature reviews / Molecular Cell Biology
La sumoylation est une des modifications post-traductionnelles couramment retrouvées sur les protéines.
Elle consiste en la fixation covalente d'un peptide, nommé SUMO, sur des sites précis de la protéine, constitués d'acides aminés lysine.
La sumoylation se fait en trois étapes et fait intervenir 2 à 3 enzymesenzymes catalytiques :
- la maturation : clivageclivage de la partie C-terminale du peptide SUMO ;
- l'activation : création d'un lien thioester entre SUMO et l'enzyme de liaison ;
- la conjugaison : le SUMO activé est fixé sur la protéine.
Il existe quatre types de protéines SUMO décrites à ce jour.
La sumoylation entraîne une modification de la protéine sumoylée : elle peut permettre le recrutement d'un nouveau partenaire, ou changer sa conformationconformation.
Bien qu'apparentée à l'ubiquitination (qui entraîne la dégradation de la protéine ciblée) dans son processus biochimique, la sumoylation permet des fonctions très différentes. On y retrouve la régulation du cycle cellulaire, la stabilisation de la protéine, le transport nucléo-cytoplasmique, la régulation de la transcriptiontranscription...