au sommaire
Une liaison intermoléculaire correspond à une liaison qui s'établit, comme son nom l'indique, entre deux molécules, de manière à maintenir une certaine cohésion entre celles-ci.
Le concept de liaison intermoléculaire est lié à celui de polarité des liaisons et des molécules impliquées. La liaison intermoléculaire ne doit pas être confondue avec la liaison intramoléculaire.
Il existe trois grands types de liaisons intermoléculaires :
- Les forces de London (appartenant aux forces de Van der Waals) ;
- Les liaisons dipôle-dipôle (appartenant aux forces de Van der Waals) ;
- Les liaisons hydrogène.
Liaisons de Van der Waals (forces de London et liaisons dipôle-dipôle)
Les forces de London -- que l'on classe dans la catégorie plus large des forces de Van der Waals -- existent entre toutes les molécules qui constituent une substance, sans condition, plus encore lorsque la surface de la molécule est importante. C'est l'exemple de ce qu'il se passe avec le butane. Ce type de liaison intermoléculaire intervient lorsqu'un dipôle instantané se crée dans la molécule en conséquence du déplacement normal des électronsélectrons au cœur de la molécule. Ainsi, le pôle positif d'une molécule attire le pôle négatif d'une autre et une liaison se crée.
Les liaisons dipôle-dipôle -- qui appartiennent également à la catégorie plus large des forces de Van der Waals -- n'interviennent que dans le cas de molécules polaires. Plus une molécule est polaire, plus les liaisons dipôle-dipôle qu'elle pourra créer avec ses voisines seront intenses.
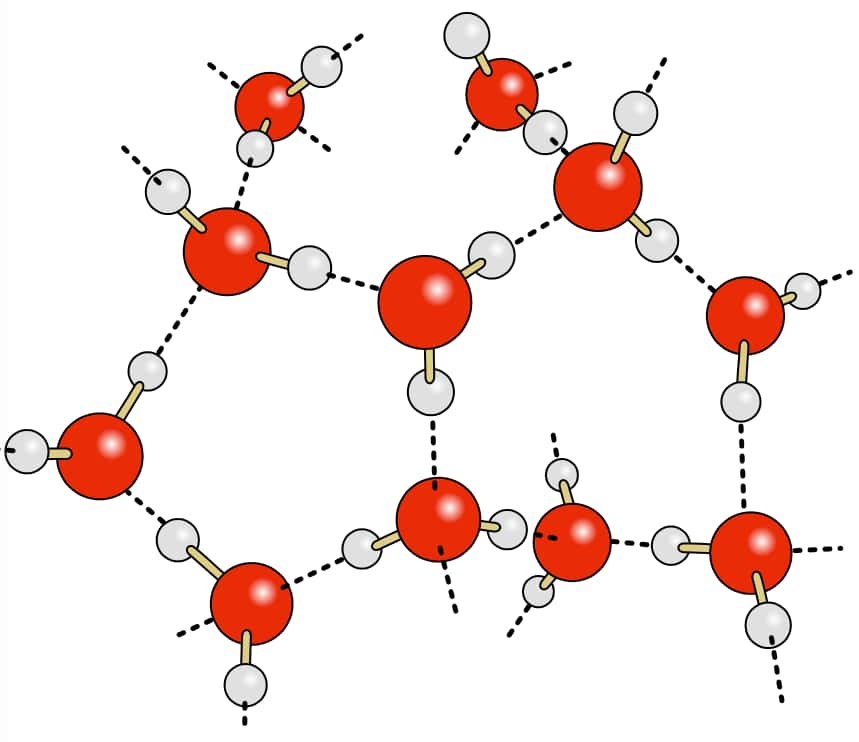
Les molécules d’eau forment entre elles des liaisons intermoléculaires fortes de type hydrogène. © chris, Wikipédia, DP
Liaison hydrogène
Les liaisons hydrogène sont les liaisons intermoléculaires les plus intenses. Elles ne se créent que lorsque les molécules présentent une liaison covalenteliaison covalente entre un atomeatome d'hydrogène et un atome d'oxygèneoxygène, d'azoteazote ou de fluorfluor.
Le tout grâce à l'électronégativité élevée et à la faible taille des atomes. C'est ce que l'on observe entre les molécules d’eau. Une liaison hydrogène est souvent représentée par une série de points ou de tirets. Il s'agit presque d'une véritable liaison covalente.