au sommaire

Johannes Diderik van der Waals (1837-1923) était un physicien et théoricien néerlandais lauréat du prix Nobel de physique en 1910. On le connaît surtout pour ses travaux sur les gaz réels et sa célèbre équation d'état de van der Waals. Reliant la température, la pression et le volume d'un gaz, elle permet de décrire l'apparition de la phase liquide d'un gaz réel, contrairement à l'équation des gaz parfaits. © DP
Johannes Diderik van der Waals (1837-1923) a fait partie des rares chercheurs à prendre au sérieux l'hypothèse atomique à la fin du XIXe siècle. Influencé par la théorie cinétique des gaz de Clausius et Maxwell, il sera ainsi conduit à découvrir en 1873 une équation plus précise et plus réaliste pour décrire le comportement des gaz réels. C'est la fameuse équation de van der Waals, capable de rendre compte de la liquéfaction d'un gaz et de son comportement autour du point critique, lorsque l'on peut passer continûment de la phase gazeuse à la phase liquide.
Pour dériver cette équation, van der Walls a non seulement admis l'existence des atomes et des molécules, mais aussi que leurs tailles étaient finies et qu'ils s'attiraient entre eux. Son équation contenait donc des termes reliés aux volumesvolumes des corpusculescorpuscules d'un gaz et d'autres reposant sur l'hypothèse de l'existence de forces intermoléculaires.
Ces forces sont aujourd'hui appelées forces de van der Waalsforces de van der Waals. On sait qu'elles découlent indirectement des interactions électrostatiquesélectrostatiques entre les charges électriques dans les atomesatomes et les molécules, même lorsque ces corpuscules sont globalement électriquement neutres. La description précise de ces forces fait intervenir la mécanique quantique. Mais cela, van der Waals ne pouvait pas le savoir à cette époque.
Des fluides supercritiques aux geckos
Van der Waals ne pouvait pas savoir non plus que ces forces seraient utilisées pour comprendre les astéroïdes ou la capacité des geckos à adhérer à différentes surfaces, même une plaque de verre. Enfin, il était bien loin de se douter de la complexité de la description microscopique des transitions de phasestransitions de phases au voisinage d'un point critique. Il faudra attendre les travaux du prix Nobel de physiquephysique Kenneth Wilson pour comprendre vraiment ce qui se passait dans ce genre de situation. Cela n'empêcha pas van der Waals d'avoir lui-même le prix Nobel en 1910. Une performance remarquable pour un homme qui a dû commencer sa vie comme instituteur et qui a surmonté de nombreux obstacles pour décrocher ensuite un doctorat et un poste universitaire.
Les forces de van der Waals, jusqu'à présent, n'avaient été mesurées que très indirectement. Or, une équipe de physiciensphysiciens français du Laboratoire Charles Fabry (LCF) et de l'université de Lille est allée plus loin en les mesurant directement, comme l'explique leur article paru sur arxiv.
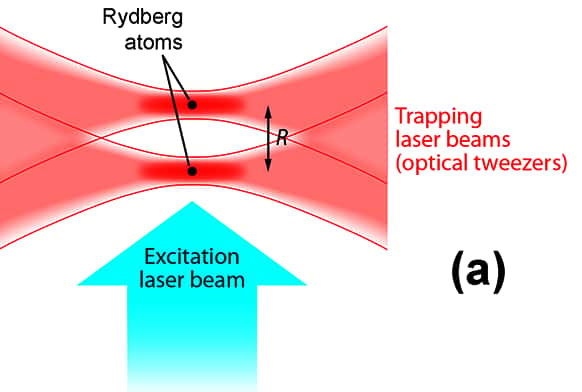
Principe de la mesure directe des forces de van der Waals. Deux faisceaux laser constituent une sorte de « pince optique » (optical tweezers) permettant de piéger deux atomes de rubidium et de les placer côte à côte à une distance précise et que l'on peut contrôler. Un troisième faisceau (bleu) permet d'exciter les atomes pour les transformer en atomes de Rydberg. © Alan Stonebraker, APS
Pour mesurer directement ces forces, les chercheurs ont fait appel à des atomes de Rydberg. Il s'agit d'atomes fortement excités possédant un ou quelques électronsélectrons sur des orbitesorbites caractérisées par un très grand nombre quantique principalnombre quantique principal n. Ces atomes sont donc assez bien décrits par le modèle de l'atome de Bohr de l'hydrogènehydrogène, sauf que leur taille est n2 plus grande que celle de cet atome. Comme ces atomes sont de grande taille, les électrons excités peuvent former avec l'atome un dipôle électrostatique dont la valeur est plus élevée qu'avec le même atome dans son état fondamentalétat fondamental. Comme certaines forces de van der Waals sont en fait des interactions électrostatiques entre les deux dipôles de deux atomes neutres, elles seront plus fortes et plus facilement mesurable entre deux atomes de Rydberg.
Des oscillations quantiques de Rabi avec des atomes de Rydberg
Dans leurs expériences, les physiciens français ont commencé par piéger deux atomes de rubidiumrubidium dans des faisceaux laser proches. Les atomes de rubidium sont fréquemment utilisés pour obtenir des atomes de Rydbergatomes de Rydberg et, dans cette expérience, il est possible d'exciter un seul des atomes ou les deux à la fois à l'aide d'un troisième laserlaser pour les transformer en atomes de Rydberg. Le système complet des deux atomes se met alors à osciller entre deux états quantiques, celui avec les deux atomes dans leur état fondamental et celui avec deux atomes de Rydberg.
Comme ces oscillations dépendent de l'intensité des forces de van der Walls entre les atomes, leur mesure permet d'avoir accès directement aux valeurs de ces forces. En outre, il est possible de contrôler précisément la distance entre les deux atomes et de la faire varier, et donc de changer à volonté l'intensité des forces de van der Walls entre les deux atomes de rubidium. Les chercheurs ont ainsi pu montrer que ces forces varient bien selon une loi en 1/R6 comme le dictent les lois de la mécanique quantiquemécanique quantique.
Des atomes de Rydberg intriqués
Mais le plus fascinant dans ces expériences n'est probablement pas la mesure directe des forces de van der Walls. C'est le fait que les deux atomes en interaction constituent un système intriqué. Plus précisément, ces atomes de Rydberg intriqués ont un comportement qui peut être vu comme celui d'une porteporte logique quantique, c'est-à-dire un élément d'un calculateur ou d'un ordinateur quantique.
Comme on peut manipuler les atomes de Rydberg avec précision dans cette expérience, cela laisse espérer fabriquer des calculateurs quantiquescalculateurs quantiques performants avec quelques dizaines d'atomes de Rydberg. On pourra peut-être s'en servir pour réaliser des simulateurs quantiques intéressants en chimie ou en physique.























