au sommaire
De l'eau qui passe de l'état liquideétat liquide à l'état solideétat solide à une température excédant les 100 °C, c'est incroyable... et pourtant bien vrai si l'on se fie à une expérience menée par des chercheurs du Massachusetts Institute of Technology (MIT). Une expérience dans laquelle ils ont confiné de l'eau dans des nanotubes de carbone.
Comment ont-ils réussi cette prouesse ? Cela reste un mystère, reconnaissent-ils, car les nanotubes de carbone sont réputés hydrophobes. Pourtant, des molécules d'eau sont parvenues à se frayer un chemin dans ces minuscules tuyaux à peine plus larges qu'elles-mêmes. Les chercheurs du MIT ont alors fait monter la température et là, surprise !
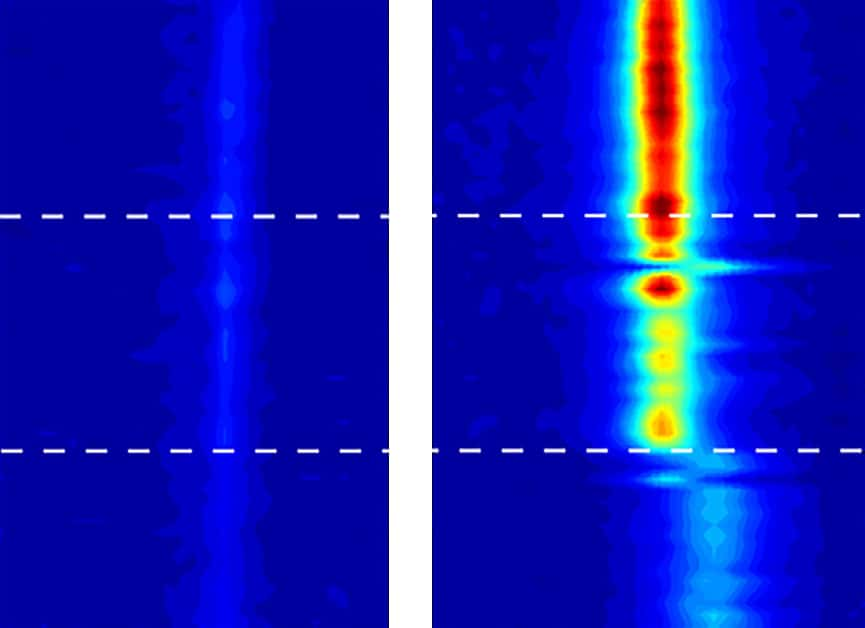
Des images en spectroscopie vibrationnelle — qui permettent de révéler les mouvements des molécules d’eau — ont trahi le comportement de l’eau confinée dans des nanotubes de carbone. À gauche, l’eau sous sa forme liquide. À droite, une eau qui commence à se solidifier au-delà de 100 °C. © Michael Strano, Massachusetts Institute of Technology
Le diamètre des nanotubes influe sur la température de solidification
À une température de 105 °C -- température à laquelle, en principe, l'eau devrait passer à l'état gazeuxétat gazeux --, ils ont commencé à voir apparaître des signes d'un passage de l'eau à un état solide ! Un état solide qu'ils se refusent pour l'heure d'appeler « glace », car malgré la précision de leurs mesures -- effectuées à l'aide d'un système de spectroscopie vibrationnelle --, ils n'ont pas pu en déterminer la structure cristalline particulière.
Ce qu'ils assurent en revanche, c'est qu'une infime variation du diamètre des nanotubes (entre 1,05 et 1,06 nanomètre) a de grandes conséquences -- plusieurs dizaines de degrés -- sur la température de solidificationsolidification en question. De quoi envisager sérieusement de concevoir des câbles à eau permettant de conduire le courant protonique 10 fois plus efficacement que des câbles classiques.