au sommaire
Augmenter l'autonomie, réduire la taille et le coût des batteries au lithium est un défi scientifique et technique parfois comparé à la quête du Saint Graal. Des chercheurs de l'université de Stanford aux États-Unis ont peut-être réussi cet exploit... Ils ont créé une anodeanode en lithiumlithium qui augmente considérablement les rapports puissance/volumevolume et puissance/poids, et multiplie par trois ou quatre la capacité d'une batterie. Concrètement, l'autonomie des futures batteries lithium des smartphones et autres appareils mobilesmobiles pourrait tripler tandis que la taille et le coût des batteries des voitures électriques baisseraient significativement.
Pour mesurer l'importance de la réalisation de l'équipe de Stanford, il faut d'abord se remémorer le fonctionnement d'une batterie lithium-ionbatterie lithium-ion. Elle se compose de trois éléments : l'électrolyte qui fournit les électronsélectrons, l'anode qui les transfère au circuit et la cathodecathode qui les reçoit. Le lithium se trouve dans l'électrolyte. Actuellement, l'anode des batteries est en graphitegraphite qui a l'avantage d'être peu onéreux et de conserver sa capacité sur des centaines de cycles charge-décharge. Mais le lithium offre une capacité plus de dix fois supérieure à celle du graphite : 3.860 mAh/g contre 350 mAh/g. Le problème est que le lithium est beaucoup moins stable.
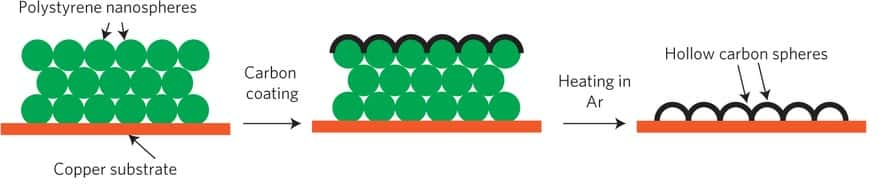
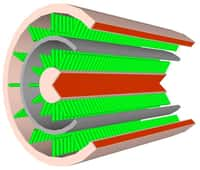
Le processus de fabrication du film isolant pour créer l’anode en lithium consiste à déposer des nanoparticules de polystyrène (polystyrene nanospheres) sur un substrat en cuivre (copper substrate). Une couche de carbone amorphe (carbon coating) vient recouvrir les nanoparticules. Le tout est ensuite chauffé (heating in Ar) avec de l’air pulsé pour obtenir la structure finale, constituée de sphère de carbone creuses (hollow carbon spheres). © Stanford University
Le lithium est très performant mais instable
Une anode en lithium reste cependant problématique. Durant les cycles charge-décharge, ce métalmétal s'élargit et se contracte, provoquant des fissures à la surface de l'anode et des excroissances appelées dendritesdendrites. Cela engendre des courts-circuitscourts-circuits et grève la duréedurée de vie de la batterie. Autre difficulté, l'anode en lithium réagit violemment lorsqu'elle entre en contact avec l'électrolyte et surchauffe au point de faire brûler ou exploser la batterie. Pour contourner ces obstacles, les chercheurs de Stanford ont construit une couche protectrice faite de ce qu'ils appellent des nanosphères de carbonecarbone. Dans leur article scientifique publié par Nature Nanotechnology, ils expliquent que ce film de 20 nanomètresnanomètres d'épaisseur, dont la structure est en nid d'abeille, est à la fois flexible et uniforme, suffisamment pour supporter l'expansion et la contraction du lithium lors des cycles charge-décharge. De plus, il isole le lithium de toute réaction chimiqueréaction chimique avec l'électrolyte qui empêchait jusque-là son utilisation.
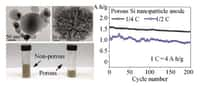
Pour être commercialisable, une batterie doit assurer un rendement faradique (rapport entre la quantité, en ampèresampères-heures, débitée à la décharge et celle envoyée à la charge) d'au moins 99,9 %. Grâce à son anode en lithium, l'équipe de Stanford a obtenu un rendement de 99 % sur plus de 150 cycles charge-décharge. Les tentatives précédentes avec des anodes en lithium non isolées ne dépassaient pas les 96 % et tombaient à moins de 50 % au bout de 100 cycles. Les chercheurs expliquent qu'ils doivent progresser du côté de l'électrolyte afin de pouvoir atteindre le seuil des 99,9 %. Ils n'ont pas fixé de feuille de route précise, mais on peut raisonnablement estimer que leur innovation fera progresser les batteries lithium-ion dans les années qui viennent.