au sommaire

Les résultats déjà obtenus
Résultats in vitro et ex-vivo
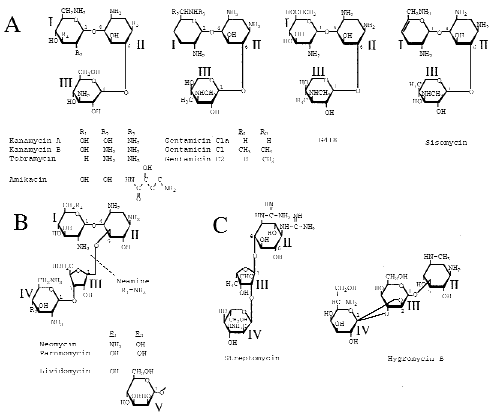
De nombreuses études ont été réalisées in vitroin vitro et ont démontré la validité de l'approche. Ainsi il a été montré que les aminoglycosidesaminoglycosides: gentamicine, tobramycine, amikacine et G418 étaient capables de restaurer l'expression de gènesgènes inactivés par un codoncodon stop. Cependant l'efficacité de ces antibiotiquesantibiotiques est extrêmement dépendante du contexte nucléotidique entourant le codon stop. De plus les résultats publiés sont parfois contradictoires, ce qui rend difficile l'interprétation du rôle du contexte nucléotidique dans l'efficacité de suppression des codons stop.
Des résultats similaires ont été obtenus ex-vivo (dans des lignées de cellules en culture), sur des mutations touchant les gènes p53p53, CFTRCFTR, IDUA, DYS.
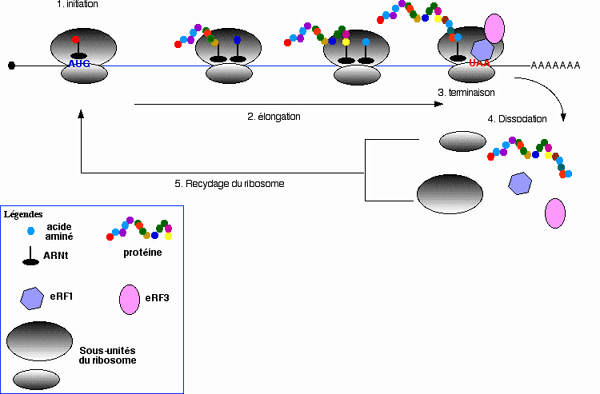
La plupart des systèmes utilisés pour quantifier l'effet de ces antibiotiques sont des systèmes reporters dans lesquels a été clonée une séquence plus ou moins grande encadrant la mutation non sens. Cette approche bien que très précieuse (et quasi irremplaçable) pour déterminer l'efficacité d'un antibiotique à supprimer un codon stop se heurte à un problème majeur. Elle ne permet pas de déterminer si la protéineprotéine exprimée par la suppression du codon stop sera active ou non. Nous avons vu que l'antibiotique favorisait l'incorporation d'un ARNtARNt au niveau du codon stop. Cet ARNt va donc permettre de continuer la traduction jusqu'au codon stop suivant et restaurer ainsi l'expression de la protéine. Mais ensuite celle-ci doit être active! Or il est tout à fait possible que l'acide aminéacide aminé incorporé via l'ARNt au niveau du codon stop modifie fortement la structure, l'activité ou la stabilité de la protéine enpêchant ainsi son fonctionnement normal.
Cependant certains chercheurs ont tiré profit de l'activité enzymatiqueenzymatique de la protéine affectée par la mutation stop pour étudier directement l'effet des antibiotiques sur l'activité de la protéine elle même. La protéine étudiée (TPPI) est codée par le gène CLN2. C'est une protéaseprotéase lysosomiale (tripeptidyl-peptidase) qui, lorsqu'elle est inactive provoque une maladie neurodégénérativemaladie neurodégénérative fatale des enfants atteints (espérance de vieespérance de vie de 8 à 15 ans) (16). Ce gène est particulièrement bien adapté à l'étude des aminoglycosides pour trois raisons.
1. La protéine possède une activité enzymatique quantifiable.
2. Certains cas cliniques ont montré que des patients possédant entre moins de 1% et 5% d'activité enzymatique ont une durée de vie rallongée (20 à 40 ans), que la maladie apparaissait plus tardivement (6-8 ans au lieu de 2-4 ans) et que souvent les symptômessymptômes étaient moins sévères.
3. Dans plus de 50% des cas, le gène est inactivé par la présence d'une mutation non-sens et comme actuellement aucun traitement n'existe contre cette maladie, la mise au point d'une thérapiethérapie à base d'aminoglycosides pourrait améliorer significativement la vie de certains malades.

Coupe en immunohistochimie de myotudes (cellules musculaires) provenant de souris saines ou de souris mdx. La présence de dystrophine est révélée par un anticorps dirigé contre la partie terminale de la protéine. Le marqueur fluorescent rouge utilisé pour cette détection est la rhodamine. On constate très clairement la réapparition de la dystrophine dans les cellules traitées à la gentamicine.
Les études ont portées sur trois mutations différentes. Les résultats ont montré aucune suppression de la mutation Gln66. En revanche l'addition de 60 microgramme/ml de gentamicine a permis de retrouver 8% d'activité TPPI dans des cellules dont le gènes CLN2 possédait les mutations Arg127 et Arg208 (cellules hétérozygoteshétérozygotes), enfin 0.5% d'activité ont été mesuré après traitement à la gentamicine dans les cellules possédant seulement la mutation Arg208 (17). Les auteurs expliquent que ces différences peuvent provenir de différents paramètres, tels que la stabilité de l'ARNmARNm (les ARNm contenant un codon stop précoce sont instables), la durée de vie de la protéine etc...Quoiqu'il en soit ces résultats montrent qu'il est possible de restaurer l'activité d'une protéine par l'utilisation de la gentamicine. Cette restauration n'est pas complète, mais est significative surtout si on prend en compte qu'il peut suffire de quelques % d'activité pour annuler l'effet de la mutation stop.
Des résultats publiés en janvier 2002 par une équipe américaine montrent qu'il est possible de supprimer des mutations du gène p53 dans des cellules fibroblastiques embryonnaires de rats (13). Grâce à une quantificationquantification précise de l'efficacité de suppression, mais aussi grâce à l'utilisation d'un test indirect de l'activité de la protéine p53, ils ont montré que les cellules traitées avec 200g/ml de gentamicine, ou 800mg/ml d'amikacine possédaient une activité p53 significative. Ces résultats sont très importants car ils démontrent que la protéine p53 qui est une cible majeure de mutations entraînant des cancerscancers chez l'homme peut récupérer une partie de son activité après un traitement à la gentamicine ou l'amikacine.
Résultats in-vivo
Les résultats les plus prometteurs à ce jour, ont été obtenus chez la souris. Il existe une mutation chez la souris (mutation mdx) qui sert de modèle animal à la myopathie de Duchennemyopathie de Duchenne. Le gène affecté par la mutation est le gène codant la dystrophine musculaire, qui est une protéine de structure des muscles. Les signes de la maladie apparaissent vers 3 ans, petit à petit une faiblesse musculaire apparaît. Cette faiblesse musculaire atteint les muscles moteurs, mais aussi les muscles respiratoires et le cœur. La membrane des cellules musculairecellules musculaire étant fragilisée, elle ne résiste pas aux efforts de contractions. Les cellules se détruisent relargant dans le sang une enzyme musculaire la Créatine KinaseCréatine Kinase (CK) qui est mesurable.
Les souris mdx possèdent une mutation non-sens dans le gène codant la dystrophine résultant d'une absence de dystrophine dans les muscles. Les chercheurs ont traité les souris avec de la gentamicine, soit par injection, soit en continu par un mécanisme de pompe. Les résultats montrent qu'après le traitement à la gentamicine, il est de nouveau possible de mettre en évidence la présence de la dystrophine dans les muscles (10 à 20% de la quantité normale), que ceux-ci sont moins fragiles, qu'une certaine activité est retrouvée et que le niveau de CK dans le sang est significativement diminué indiquant une meilleure résistancerésistance des cellules musculaires (18). Cependant les auteurs notent que la concentration en gentamicine diminue très rapidement pour atteindre 4 heures après l'injection une concentration très faible (1g/ml) qui est maintenue pendant 24h. Cette rapiditérapidité de métabolisation de l'antibiotique peut être un problème pour son efficacité.
Si ces résultats sont très encourageants il convient de les relativiser. Tout d'abord, d'autres équipes ont échoué en tentant de reproduire ces résultats. Ceci peut être expliqué par l'utilisation de lots de gentamicine ayant des compositions différentes (la gentamicine disponible commercialement est un mélange de trois formes de gentamicine, qui varient en proportion). Or comme aucune solution de gentamicine pure n'existe actuellement, il n'est pas possible de déterminer lequel des ces trois composants est efficace. Ensuite, la mutation stop présente chez la souris mdx est UAAA, qui d'après d'autres chercheurs ne permet pas plus de 1% de suppression du codon stop dans les cellules en culture. Or les auteurs reportent 10 à 20% de dystrophine chez la souris. Il n'est donc pas impossible que la restauration de l'expression de la protéine se fasse par un autre mécanisme que la suppression du codon stop chez la souris (un épissageépissage alternatif de l'ARNARN pré-messager par exemple).
Actuellement trois essais cliniquesessais cliniques chez l'homme ont été entrepris afin de déterminer si la gentamicine pouvait être utilisée. Ces trois essais ont donnés des résultats opposés. Les deux premiers ont montré que l'administration de gentamicine chez des patients possédant une mutation non-sens dans le gène CFTR permettait de retrouver partiellement l'expression de la protéine ainsi qu'une activité dans l'éptihélium nasal (11, 19). En revanche le troisième essai n'a montré aucune amélioration de patients atteints de la myopathie de Duchenne et traités à la gentamicine (20). Dans cet essai, il n'a pas été non plus possible de mettre en évidence la présence de la forme complète de la dystrophine.
Il est important de noter qu'il existe une différence essentielle, qui pourrait permettre d'expliquer ces différences de résultats. La protéine CFTR possède une activité enzymatique, alors que la dystrophine est une protéine de structure des muscles. Il est facilement envisageable que très peu d'une protéine ayant une activité enzymatique permette d'attenuer les effets d'une maladie, alors qu'il faudra une quantité plus importante d'une protéine de structure. Si cette hypothèse est valable, alors les maladies provenant de la disparition d'une activité enzymatique (CFTR, cancer(p53), IUDA ...) seront de meilleurs cibles thérapeutiques.