au sommaire
Batteries à recharge rapide, batteries qui évitent les explosions, batteries longue autonomie... La recherche est aujourd'hui active dans ce secteur de l'industrie, souvent pour faciliter l'utilisation de nos smartphones, tablettes et autres voitures électriquesvoitures électriques. Une autre voie de recherche pour les batteries consiste à soutenir le développement des énergies renouvelables. C'est le cas de cette innovation du Massachusetts Institute of Technology (MIT).
Les énergies renouvelablesénergies renouvelables, solaire ou éolien par exemple, sont qualifiées d'intermittentes. Elles ne permettent pas de produire de l'électricité à volonté. Il est donc indispensable de stocker l’énergie produite pendant les périodes de fort ensoleillement -- ou de grand ventvent -- pour la restituer en cas de besoin. Pour ce faire, des systèmes de stockage à grande échelle sont nécessaires, par exemple dans les STEP (stations de transfert d'énergie par pompagestations de transfert d'énergie par pompage), qui exploitent deux bassins d'eau situés à des altitudes différentes. Mais ils prennent énormément de place et ne peuvent pas être mis en œuvre partout.
Ainsi, la batterie mise au point par les chercheurs du MIT a de quoi étonner par ses caractéristiques et détonne dans le paysage. Parce qu'elle permet de stocker de l'énergie sur le long terme, pour un coût cinq fois inférieur à celui des technologies existantes et avec une densité d'énergie très élevée. Au laboratoire, elle a été estimée entre 30 et 145 Wh/L, une valeur incomparablement supérieure à celle des STEP.
Cette batterie expérimentale étonne aussi parce qu'elle... « respire » ! Plus précisément, elle inspire de l'air pendant la phase de décharge et elle expire, non pas du dioxyde de carbonedioxyde de carbone, mais de l'oxygène, pendant la phase de charge.
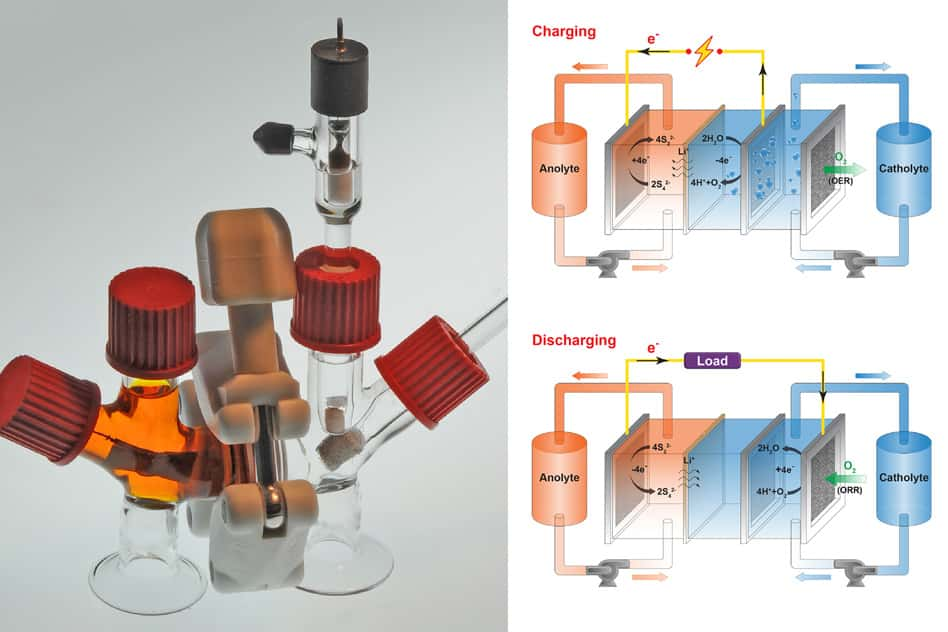
Lors de la décharge (en bas), des électrons sont libérés par l’anode liquide (anolyte). Parallèlement, la cathode, liquide elle aussi (catholyte), inspire de l’oxygène et produit des ions hydroxydes (HO- ) assurant l’électroneutralité de l’ensemble. Pendant la charge (en haut), de l’oxygène est expulsé de la cathode. Des ions hydrogène (H+) apparaissent. Les électrons sont repoussés vers l’anode. © Felice Frankel, Massachusetts Institute of Technology
Une batterie qui respire ?
Pour fabriquer leur batterie, les chercheurs américains ont creusé le concept de la batterie à flux dont les électrolytes circulent en permanence à travers des électrodes liquides. Pour l'anode, ils se sont tournés vers une solution de polysulfure contenant des ionsions lithiumlithium ou sodiumsodium. Parce que la densité d'énergie du soufre est intéressante et parce que l'élément est abondant et bon marché. Pour la cathodecathode, le choix s'est avéré plus délicat.
Parmi les candidats : le permanganate de potassiumpermanganate de potassium. Sa réduction permet de décharger la batterie. Mais elle est en principe irréversible, empêchant donc de recharger la batterie. Pourtant, lors des premiers tests, quelque chose d'incroyable s'est produit. La batterie s'est rechargée. Grâce à une réaction inattendue au niveau de la cathode qui fonctionnait à l'air libre.
Alors les chercheurs du MIT ont opté pour une cathode faite d'une solution saline oxygénée. Et le miracle s'est reproduit. En intégrant de l'air pendant la décharge, la cathode crée des ions hydroxyde. Pendant la recharge, l'oxygène est relâché et des ions hydrogènehydrogène sont libérés, renvoyant les électronsélectrons vers l'anode. Pour l'heure, le prototype du MIT n'est pas plus grand qu'une tasse de café. Mais les chercheurs sont confiants dans les possibilités de passage à des dimensions industrielles.
Ce qu’il faut
retenir
- Les chercheurs du MIT ont mis au point une batterie qui stocke de l’électricité en inspirant et en expirant de l’oxygène.
- Ils promettent un stockage aussi efficace et environ cinq fois moins coûteux qu’avec les systèmes existants.
























