au sommaire
La Food and Drug AdministrationFood and Drug Administration (FDA), l'agence américaine des médicaments, a approuvé lundi la mise sur le marché de l'antirétroviral Truvada, premier traitement de préventionprévention contre le Sida destiné aux personnes à risque qui devrait contribuer, selon les autorités, à réduire les nouvelles infections.
Suivant une recommandation d'un comité d'experts, la FDA a validé l'utilisation de cet antirétroviral du laboratoire américain Gilead Sciences, « afin de réduire le risque de transmission du virus du Sida (VIH) à des sujets sains à haut risque d'être contaminés », a précisé l'agence dans un communiqué.
Le Truvada ne remplace pas les préservatifs
Le médicament, pris quotidiennement, est destiné « à être utilisé à titre prophylactique avant un contact avec le VIH (virus de l'immunodéficience humaine), en combinaison avec des pratiques sexuelles sûres comme l'usage de préservatifs et d'autres mesures de prévention - dépistagedépistage régulier et traitement d'autres maladies vénériennesmaladies vénériennes - pour empêcher la transmission du virus chez des adultes à haut risque », a souligné l'agence. « Le TruvadaTruvada ne peut pas se substituer à des pratiques sexuelles sûres », insiste la FDA dans ce même communiqué.
Ce feufeu vert intervient juste avant la Conférence internationale sur le Sida qui se tiendra à Washington du 22 au 27 juillet et dont le thème est : « Renverser la tendance de la pandémiepandémie » pour y mettre fin.
Réduire les infections au VIH de 25 % dans les années à venir
« L'approbation du Truvada marque une étape importante dans notre lutte contre le VIH », a déclaré Margaret Hamburg, directrice de la FDA. « Chaque année, environ 50.000 adultes et adolescents américains sont diagnostiqués d'une infection par le VIH malgré la disponibilité de méthodes de prévention, de stratégies d'éducation, de tests de dépistage et de soins pour les personnes vivant avec le virus », précise-t-elle dans le communiqué.
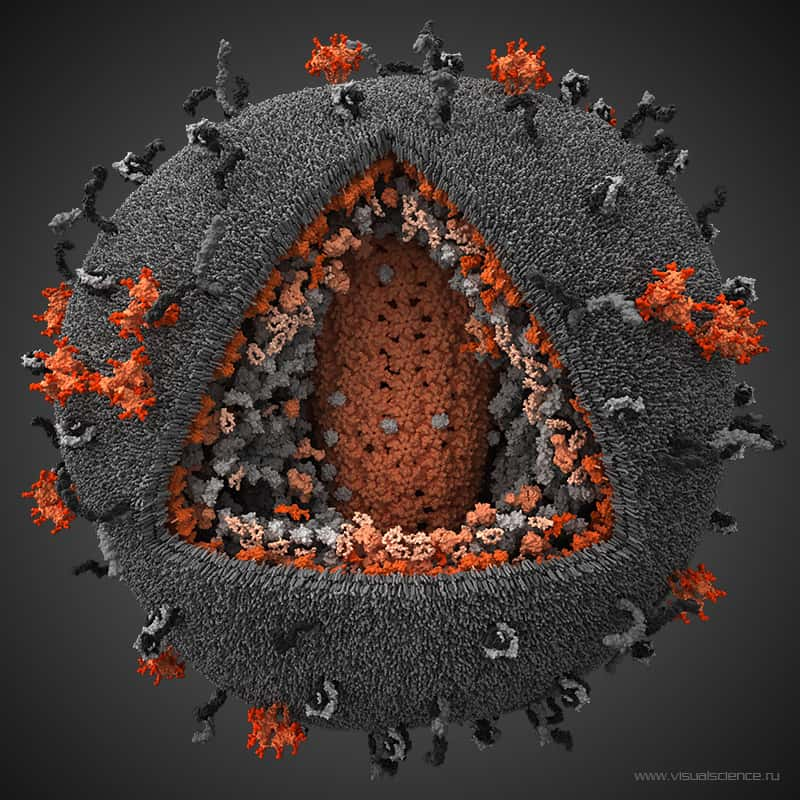
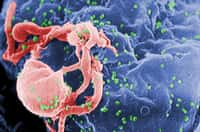
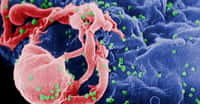
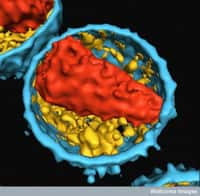
Le VIH, représenté ici de manière schématique, s'attaque aux lymphocytes CD4, des cellules du système immunitaire. Peu à peu les défenses de l'organisme sont anéanties : c'est le Sida. La maladie reste incurable, alors autant prévenir sa transmission. © Visualscience
L'objectif aux États-Unis est « de réduire le nombre des nouvelles infections de 25 % d'ici 2015 », a par ailleurs indiqué lors d'une conférence de presse Debra Birnkrant, directrice de la division des produits antivirauxantiviraux à la FDA. Et « nous nous attendons à ce que l'approbation du Truvada contribue à atteindre cet objectif », a-t-elle ajouté. Le coût de ce traitement varie de 12.000 à 14.000 dollars par an.
Enfin un médicament préventif efficace contre le VIH
L'efficacité préventive du Truvada a été mise en évidence par les résultats d'un essai clinique mené avec 2.499 hommes homosexuelshomosexuels séronégatifsséronégatifs de 2007 à 2009 dans six pays, dont le Brésil, l'Afrique du Sud et les États-Unis, et financé en grande partie par les National Institute of Health (NIH), les instituts américains de la santé.
Il avait alors réduit de 44 % le risque d'infection chez les participants qui utilisaient aussi un préservatif comparativement à ceux soumis à un placéboplacébo.
Une autre étude cliniqueétude clinique avec 4.875 couples hétérosexuels sérodiscordants (seul l'un des deux est séropositif) a montré une baisse du risque d'infection jusqu'à 75 % chez les partenaires séronégatifs qui ont pris du Truvada comparativement au groupe témoin.
Le Truvada fait toujours débat
Le médicament, combinant deux antirétroviraux, avait été initialement approuvé par la FDA en août 2004 pour être utilisé avec d'autres antirétroviraux afin de traiter des adultes touchés par le VIH et des enfants de 12 ans et plus.
Aucun nouvel effet secondaire n'a été identifié lors de ces derniers essais cliniques destinés à évaluer les capacités préventives du Truvada. Les effets secondaires les plus courants sont la diarrhéediarrhée, des nausées, des douleursdouleurs abdominales, des maux de tête et une perte de poids et les plus graves, très rares, affectent les reinsreins et les os.
Le responsable de l'ONG AIDS Healthcare Foundation, Michael Weinstein, a jugé « irresponsable » la décision de la FDA, d'autoriser le Truvada comme traitement préventif sans « obligation de test de dépistage » du VIH. Selon lui, cela « finira par faire régresser les efforts de prévention menés depuis plusieurs années ».