au sommaire
Le vieil adage rappelle que la nature fait bien les choses. En cas de blessure, notre sang coagule grâce à la réaction en chaîneréaction en chaîne de nombreuses moléculesmolécules afin d'éviter des hémorragies trop importantes et l'intrusion de pathogènes. Les processus se font rapidement, localement et s'inversent aussitôt que les dangers sont repoussés.
Mais quand l'Homme veut imiter la nature, bien souvent il se brûle les ailes. Parfois, les chirurgiens sont obligés de fluidifier le sang de leurs patients à l'aide de médicaments anticoagulants, comme l'héparine ou la warfarine. Cependant, ces molécules n'agissent que dans un sens, et il faut attendre qu'elles disparaissent de l'organisme pour que le sang retrouve ses facultés naturelles. Or, ces substances constituent la première cause de mortalité due à des effets secondaires de médicaments utilisés dans un cadre thérapeutique.
Alors, pour un meilleur contrôle du processus dans le cadre d'opérations chirurgicales, des chercheurs du MIT en sont venus à proposer d'utiliser directement un « interrupteur marche-arrêt » de la coagulation, afin d'éviter des drames aux patients traités. Leur technique, décrite dans Plos One, nécessite des nanoparticulesnanoparticules d'or, de l'ADN et un rayon laserlaser.
Charger de l’or avec de l’ADN
Comme précisé plus haut, la coagulation exige une cascade de réaction et de réactifsréactifs. Les auteurs, dirigés par Kimberly Hamad-Schifferli, se sont intéressés à la dernière étape, qui voit la petite protéine fibrinogène transformée en fibrinefibrine par l'action d'une enzymeenzyme, la thrombine. Il avait été montré il y a quelques années qu'un brin d'ADN spécifique avait de l'affinité pour la région de l'enzyme nécessaire à la réaction. En se liantliant ainsi, l'ADN empêche la formation de la fibrine et bloque donc la coagulation.
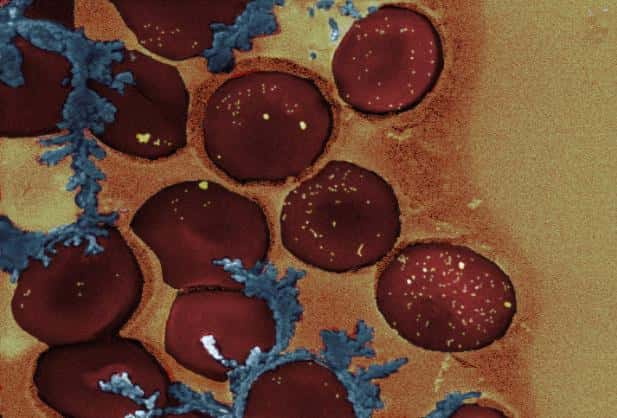
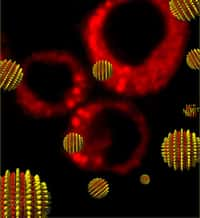
Cette image représente des globules rouges entourés de nanoparticules d'or (petits points jaunes) chargées d'ADN et qui s'activent au contact d'un rayonnement laser. © Helena de Puig
Pour la réactiver, les scientifiques utilisent un autre brin d'ADN, complémentaire au premier, ce qui lui confère une forte affinité. Ainsi, dans le milieu, le premier fragment va libérer la thrombine pour se lier au second brin.
Si l'on comprend bien le principe, jusque-là, le problème suivant consiste à faire en sorte de libérer chaque fragment d'ADN au moment opportun. Tâche complexe. Mais pas insurmontable.
Un rayon laser en guise d’interrupteur de la coagulation
La première idée des auteurs consistait à déposer ces brins d'acides nucléiquesacides nucléiques sur des nanoparticules d’or. Mais en procédant ainsi, ils ne disposaient pas d'assez d'ADN pour obtenir l'effet désiré. Alors ils ont profité d'une particularité de l'or : dans l'organisme, de nombreuses protéines viennent s'agglutiner autour du métalmétal précieux. Dans une recherche précédente, ces mêmes scientifiques avaient montré qu'il était possible de se servir de ce processus pour charger en médicaments ces nanoparticules. Sur la base de ce principe, ils ont réussi à multiplier par six la quantité d'ADN déposée.
Ils ne disposaient pas d'un, mais de deux types de nanoparticules. Les plus fines (35 nm) contenaient le brin d'ADN inhibiteur de la coagulation. Les plus grosses (60 nm) étaient équipées du fragment complémentaire. En envoyant un rayonnement laser à une longueur d'ondelongueur d'onde particulière, les électronsélectrons des premières sphères dorées s'excitent et chauffent l'ensemble, ce qui aboutit à la libération de l'ADN qui va alors se lier à la thrombine. Lorsque l'on veut retrouver une coagulation normale, on change la longueur d'onde, les autres nanoparticules libèrent leur contenu et l'antidoteantidote vient faire effet.
Le concept a été testé sur du sang issu des hôpitaux. La prochaine étape consistera à faire en sorte que les nanoparticules se dirigent spécifiquement sur le site d'une blessure. Ensuite, il faudra pouvoir les exciter en envoyant le rayonnement laser à travers la peau. Il faudra donc attendre un peu avant de généraliser la pratique chez l'Homme.